
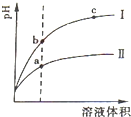
 ��������0.1mol?L-1������ҺNaOH��NH3?H2O��HCl��CH3COOH
��������0.1mol?L-1������ҺNaOH��NH3?H2O��HCl��CH3COOH| [H+] |
| [CH3COOH] |
| [H+] |
| [CH3COOH] |
| 10-3 |
| 0.1 |
| 10-14 |
| 10-3 |
| [NH4+]?[OH-] |
| [NH3?H2O] |


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ڢۢ� | B���ܢۢڢ� |
| C���٢ۢڢ� | D���ܢڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ֻҪ��֤����ȫȼ�պ����ֻ��H2O��CO2 |
| B��ֻҪ�ⶨ��ȼ�ղ�����H2O��CO2���ʵ����ı�ֵ |
| C���ⶨ����������������������ȫȼ�պ�����H2O��CO2������ |
| D���ⶨ��ȫȼ��ʱ�����л���������H2O��CO2�����ʵ���֮�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����֪2H2��g��+O2��g��=2H2O��g����H=-483.6 kJ?mol-1����������ȼ����Ϊ241.8kJ?mol-1 |
| B����֪C��ʯī��s��=C�����ʯ��s����H=+1.9kJ?mol-1������ʯ��ʯī�ȶ� |
| C����0.5mol NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�26.7kJ�����������ʾ�÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽΪ��OH-��aq��+H+��aq��=H2O��l����H=-53.4kJ?mol-1 |
| D����֪2H2S��g��+O2��g��=2S��g��+2H2O��l����H1��2H2S��g��+3O2��g��=2SO2��g��+2H2O��l����H2�����H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Ũ����մ��Ƥ���ϣ�����������������Һ��ϴ |
| B����������ķ�Һ����ˮ�ۣ���ˮ������ˮ�� |
| C������������ʹNaCl����Һ������ʱ��Ӧ����������NaCl��Һȫ���������� |
| D���������ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ֧�ܿڴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1 mol��������ˮ������2 mol CH3CH2OH��2 mol CO2 |
| B���ڼ�������Һ�зֱ���뱥��Na2SO4��CuSO4��Һ�������������������� |
| C����֬���Ǹ߷��ӻ����1 mol��֬��ȫˮ������1 mol���ͺ�3 mol��֬���� |
| D������������ˮ������Ƿ���л�ԭ�ԣ�����ˮ������Һ��ֱ�Ӽ������Ƶ�Cu��OH��2����Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��SO32- |
| B��ClO4- |
| C��NO2- |
| D��ClO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com