
分析 (1)①二氧化硫具有漂白性,而二氧化碳没有,可选用品红溶液鉴别;
②碳酸钠与氯化钙溶液反应生成碳酸钙沉淀,而碳酸氢钠不反应;
(2)A.配制溶液用玻璃棒搅拌和引流;
B.稀释浓硫酸时需要用玻璃棒搅拌;
C.用CCl4萃取碘水中的碘,主要仪器为分液漏斗,不会使用玻璃棒;
D.氢氧化铁胶体的制备实验中不会使用玻璃棒;
E.用充满氨气的烧瓶做喷泉实验,主要使用圆底烧瓶和烧杯,不会使用玻璃棒.
解答 解:(1)①SO2具有漂白性,而CO2不具有漂白性,故可用C.品红溶液鉴别二者,
故答案为:C;
②Na2CO3与氯化钙溶液反应生成白色沉淀,而NaHCO3不与CaCl2溶液反应,可用D.CaCl2溶液鉴别二者,
故答案为:D;
(2)A.配制一定物质的量浓度的溶液用玻璃棒搅拌和引流,故A错误;
B.稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散,故B错误;
C.用CCl4萃取碘水中的碘,主要用到分液漏斗和烧杯,不需要玻璃棒,故C正确;
D.氢氧化铁胶体的制备中不会用到玻璃棒,故D正确;
E.用充满氨气的烧瓶做喷泉实验,主要用到圆底烧瓶、烧杯等,不会用到玻璃棒,故E正确;
故答案吴娜:CDE.
点评 本题考查了物质检验鉴别方案的设计,题目难度中等,注意掌握常见物质的性质及鉴别方法,明确玻璃棒在化学实验中的作用为解答关键,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | H$\underset{\stackrel{\;}{C}}{•}$$\underset{\stackrel{\;}{l}}{•}$ | B. | $\underset{\stackrel{\;}{F}}{•}$$\underset{\stackrel{\;}{e}}{•}$Cl2 | C. | K$\underset{\stackrel{\;}{M}}{•}$$\underset{\stackrel{\;}{n}}{•}$O4 | D. | Na2$\underset{\stackrel{\;}{S}}{•}$O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
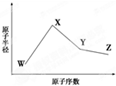 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/ kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.
,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.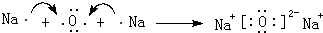 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
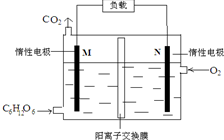 一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )
一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )| A. | 与等量的C6H12O6完全燃烧放热比较,该装置发电效率高 | |
| B. | 若用该电池电解氧化铝制铝,与N极相连的电极有气体生成 | |
| C. | 电子流向:M→负载→N→电解质溶液→M | |
| D. | 当N极消耗5.6L(标况下)气体时,最多有NA个H+通过阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用元素周期律研究元素及其化合物的性质具有重要意义.
运用元素周期律研究元素及其化合物的性质具有重要意义.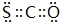 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过氧化氢酶在重金属盐的作用下会失去活性 | |
| B. | 油脂的硬化是指含有不饱和键的油脂发生的催化加氢的反应 | |
| C. | 即使条件不同,卤代烷烃与强碱反应生成的有机物也都只有一种 | |
| D. | 有机物都是由碳、氢和氧三种元素组成的,含有碳元素的物质都是有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com