
【题目】室温下,![]() 的
的![]() 二元酸的正盐
二元酸的正盐![]() 溶液中含A原子的粒子所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
溶液中含A原子的粒子所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )

A.NaHA溶液显碱性
B.![]() 时,
时,![]()
C.![]() 时,
时,![]()
D.室温下,![]() 的电离平衡常数
的电离平衡常数![]() 为
为![]()
科目:高中化学 来源: 题型:
【题目】把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )

A.a是原电池的负极B.b的活泼性大于a
C.无电流产生D.b 电极上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有铜和氧化铁的混合物ag,当慢慢滴入![]() 的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解,若将ag该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解,若将ag该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
A.等于![]()
![]() B.大于
B.大于![]()
![]()
C.大于![]() D.等于
D.等于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
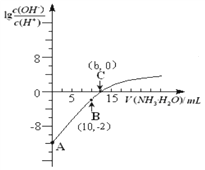
A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备K2FeO4的流程如下:

(1)配制FeSO4溶液时,需加入铁粉和稀硫酸,试说明加铁粉的原因______________________,加稀硫酸原因_______________________。
(2)用饱和KOH溶液结晶的原因是__________________。
(3)洗涤时用乙醚作洗涤剂的原因是_________________。
(4)经测定第一、二次氧化时的转化率分别为a和b,结晶时的转化率为c,若要制备d Kg的K2FeO4,则需要FeSO4·7H2O___________Kg。(K2FeO4的相对分子质量是198;FeSO4·7H2O的相对分子质量是278;答案用分数表示)
(5)电解法也能制备K2FeO4。用KOH溶液作电解液,在阳极可以将铁氧化成FeO![]() ,试写出此时阳极的电极反应式___________________________。
,试写出此时阳极的电极反应式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是

A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子材料的结构简式如图所示:已知该高分子材料是由三种单体聚合而成的,下列与该高分子材料相关的说法正确的是( )
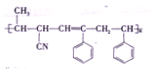
A. 该高分子材料是体型高分子,合成它的反应是加聚反应
B. 形成该高分子材料的单体![]() 中,所有原子可能处于同一平面内
中,所有原子可能处于同一平面内
C. 三种单体中有两种有机物互为同系物
D. 三种单体都可以使溴水褪色,但只有两种能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaTiO3、KH2PO4和NaNO2都属于铁电体,它们具有许多特异的性能如当它受压力而改变形状时产生电流,通电时会改变形状等。
(1)基态Ti原子的价电子排布式为___________,属于___________区元素。
(2)KH2PO4晶体中存在的作用力有___________(选填字母)。
A.离子键 B.共价键 C.氢键
(3) NaNO2中N原子的杂化类型为___,键角(填“>、<或=”)____120°,其原因是___________。N、O、Na三种元素的第二电离能(I2)由大到小的顺序为________(用元素符号表示)。
(4)BaTiO3的晶胞如下图所示:
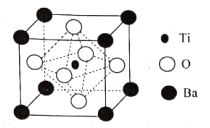
Ti原子的配位数为_____,晶体的密度为ρg/cm3,最近的Ba原子和O原子之间的距离为___(填计算式)nm。( BaTiO3的摩尔质量为233g/mol,NA为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过_____方法区分晶体、准晶体和非晶体。
(2)基态铜原子价电子排布的轨道式为______。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______、______
(4)NH4F(氟化铵)可用于玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是;氟化铵中存在______(填序号):
A.离子键B.σ键C.π键D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系关键能。则F-F键的键能为kJmol-1,S-F的键能为______kJmol-1。
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF比CuCl熔点高的原因是______;
②已知NA为阿伏加德罗常数。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=___nm(列出计算式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com