


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010--2011学年四川省高二上学期期中考试化学试卷 题型:选择题
某二元酸(简写为H2A)溶液,按下式电离: H2A=H++HA- HA-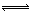 H++A2- ,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
H++A2- ,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
A.溶液肯定不显中性,但显酸性还是碱性无法确定
B.常温下0.1mol/L的NaHA溶液的PH=2
C.溶液中c(Na+)=c(HA-)+ c(A2-)
D.溶液中c(Na+)>c(HA-)>c(A2-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
某二元酸(简写为H2A)溶液,按下式电离: H2A=H++HA- HA-H++A2- ,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
A.溶液肯定不显中性,但显酸性还是碱性无法确定
B.常温下0.1mol/L的NaHA溶液的PH=2
C.溶液中c(Na+)=c(HA-)+c(A2-)
D.溶液中c(Na+)>c(HA-)>c(A2-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2010--2011学年四川省成都二十中高二上学期期中考试化学试卷 题型:单选题
某二元酸(简写为H2A)溶液,按下式电离: H2A=H++HA- HA-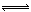 H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
A.溶液肯定不显中性,但显酸性还是碱性无法确定
B.常温下0.1mol/L的NaHA溶液的PH=2
C.溶液中c(Na+)=c(HA-)+ c(A2-)
D.溶液中c(Na+)>c(HA-)>c(A2-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com