
| ||
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
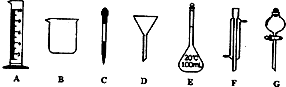
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
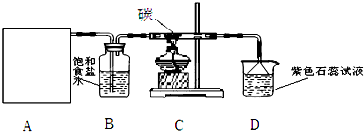
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 A��B��C��D��E����ѧ������5�ֻ����A��B�������Ԫ��X��Y�ĵ����������г����Ľ�����������ʼ�Ĺ�ϵ��ͼ��ʾ��
A��B��C��D��E����ѧ������5�ֻ����A��B�������Ԫ��X��Y�ĵ����������г����Ľ�����������ʼ�Ĺ�ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Zn��s��+CuSO4��aq���TZnSO4��aq��+Cu��s����H=-216 kJ/mol����Ӧ���������������������� |
| B����ͬ�����£����1 mol��ԭ�������е�����ΪE1��1 mol ����ӵ�����ΪE2����2E1��E2 |
| C��101 kPaʱ��2H2��g��+O2��g���T2H2O��g����H=-483.6 kJ/mol��H2��ȼ���ȡ�H=-241.8 kJ/mol |
| D��H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ/mol����1 mol NaOH������������Һ�뺬0.5 mol H2SO4��Ũ�����Ϻ�ų�57.3 kJ ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��10ml��������Ϊ98%��H2SO4����10mlˮϡ�ͺ�H2SO4��������������49% |
| B������0.1mol/L��Na2CO3��Һ480ml������500ml����ƿ |
| C���ڱ���£���22.4L��������1Lˮ�У��õ�1mol/L�İ�ˮ |
| D����2�ȷݲ����͵��ռ���Һ�зֱ����һ������Na2O2��Na2O��ʹ��Һ��ǡ�ñ��ͣ�������Na2O2��Na2O�����ʵ���֮�ȵ���1��1�������¶Ȳ��䣩 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com