
| 3 |
| 2 |
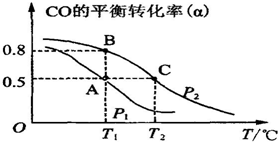
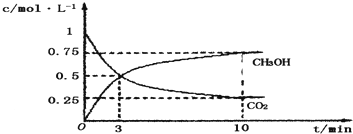
| 16 |
| 3 |
| ��c |
| ��t |
| �μӷ�Ӧ�Ķ�����̼Ũ�� |
| ������̼�ij�ʼŨ�� |
| 3 |
| 2 |
| 1-0.25 |
| 10 |
| 1-0.25 |
| 1 |
| 0.75��0.75 |
| 0.25��0.753 |
| 16 |
| 3 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ�мס���Ϊ������������أ���ش�
���ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ�мס���Ϊ������������أ���ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������м���Ũ�������ַ�������˵��ŨH2SO4������ˮ�� |
| B��Ũ�����ڹ�������ɫ��ƣ�˵��Ũ����ȶ� |
| C��ϡ��Ũ����ʱӦ��ˮ�����ձ���������ע��ʢ��Ũ������ձ��У������Ͻ��� |
| D�����᳣��������ͭ��Ӧ��˵��������ǿ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH3COOH |
| B��H2SO4 |
| C��NH4Cl |
| D��NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ǽ���������һ�����Ǽ��������� |
| B��HCl��H2S��NH3���ǵ���� |
| C��©����������ƿ����Һ©�����ζ��ܵ��������������ʷ��� |
| D��Fe��OH��3��FeCl2��CuS������ֱ���û��Ϸ�Ӧ�Ʊ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | �����Ϣ |
| T | Tԭ�����������������������ֱ�����ԭ��������� |
| X | X�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ�������ͬ |
| Z | Z���γ�Z2��Z3������̬���� |
| Q | �ڸ�Ԫ�����������У�Q�Ļ�̬ԭ�ӵĵ�һ��������С |
| R | 3p�ܼ�����1������ |
| W | W��һ�ֺ��ص�������Ϊ56��������Ϊ30 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com