
| V |
| Vm |
| n |
| V |
| m |
| n |
| M |
| Vm |
| 0.28L |
| 22.4L/mol |
| 1.325g |
| 1.44g |
| 0.025mol |
| 0.25L |
| 500 |
| 250 |
| 1.825g |
| 0.05mol |
| M |
| Vm |
| 36.5g/mol |
| 22.4L/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、2g碳燃烧生成一氧化碳时放出221.0kJ的热量 |
| B、2mol碳燃烧生成一氧化碳时吸收221.0kJ的热量 |
| C、2mol固体碳在氧气中燃烧生成2mol一氧化碳气体时放出221.0kJ的热量 |
| D、12g碳和氧气反应生成一氧化碳时放出221.0kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
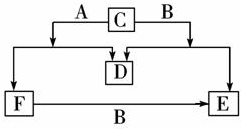 A、B、C、D、E、F六种物质中除D为气体单质外其余均为常见的化合物,E和F的水溶液均呈碱性,且都为重要的化工原料,其焰色反应为黄色,它们的转化关系如图所示.请回答下列问题:
A、B、C、D、E、F六种物质中除D为气体单质外其余均为常见的化合物,E和F的水溶液均呈碱性,且都为重要的化工原料,其焰色反应为黄色,它们的转化关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 右图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略.)
右图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略.)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


 )和双氧水为原料生产过氧化苯甲酰,写出该反应生成过氧化苯甲酰的化学反应方程式:
)和双氧水为原料生产过氧化苯甲酰,写出该反应生成过氧化苯甲酰的化学反应方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.05 mol/L |
| B、0.1 mol/L |
| C、0.2 mol/L |
| D、0.3 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com