
在MnO2和浓盐酸的反应中,如果有17.4 g MnO2被还原,那么参加反应的氯化氢有多少克?被氧化的氯化氢的物质的量是多少?(已知:![]() )
)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(已知:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
在MnO2和浓盐酸的反应中,如果有17.4 g MnO2被还原,那么参加反应的氯化氢有多少克?被氧化的氯化氢是多少摩尔?
(已知:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)在MnO2和浓盐酸的反应中,如果有17.4 g MnO2被还原,那么参加反应的氯化氢有多少克?被氧化的氯化氢的物质的量是多少?(已知:MnO2+4HClMnCl2+Cl2↑+2H2O)
查看答案和解析>>
科目:高中化学 来源:2013届吉林省长春外国语学校高二上学期期中考试化学(理)试卷 题型:计算题
(10分)在MnO2和浓盐酸的反应中,如果有17.4 g MnO2被还原,那么参加反应的氯化氢有多少克?被氧化的氯化氢的物质的量是多少?(已知:MnO2+4HCl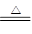 MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com