
分析 (1)除去Fe2+时,应避免Cu2+生成沉淀;加入氧化剂时,不能引入新的杂质;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质;
(3)铜离子水解生成盐酸易挥发,不能得到氯化铜.
解答 解:(1)由题给信息可知,除去Fe2+时,应避免Cu2+生成沉淀,如直接调整溶液pH=9.6,则生成氢氧化亚铁的同时,氢氧化铜、氢氧化铁也同时生成;加入氧化剂时,不能引入新的杂质,如用NaClO,则可引入NaCl杂质,浓硝酸、高锰酸钾的还原产物均引入新杂质,应加入过氧化氢,故答案为:Cu2+也被完全沉淀了;②;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质,氨水、NaOH均引入新杂质,则可用CuO 或Cu(OH)2或CuCO3;
故答案为:①③;
(3)加热促进铜离子水解,铜离子水解生成盐酸易挥发,不能得到氯化铜,故答案为:不能.
点评 本题考查较为综合,涉及物质的分离、提纯和制备,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及题给信息,题目难度不大.


科目:高中化学 来源: 题型:填空题
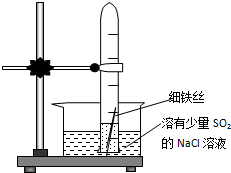 有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:
有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是黄绿色气体,有毒,有刺激性气味,氯水还可杀菌消毒 | |
| B. | 液氯就是氯气的水溶液,它能使干燥的有色布条褪色 | |
| C. | 红热的铁丝在Cl2中燃烧产生棕色的雾;H2在Cl2中燃烧火焰呈淡蓝色 | |
| D. | 氯水长时间放置会变质,是因为氯气几乎完全挥发,剩下的就是水. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业对工、农业生产和国防都有重要意义.
合成氨工业对工、农业生产和国防都有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | Ⅷ | ||||||
| ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | ④ | ⑧ | ||||
| ⑤ | ⑥ | ⑦ | ⑨ | ||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3是碱 | B. | NaHCO3是正盐 | C. | NaHCO3是强酸盐 | D. | NaHCO3是酸式盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-7 mol/L | B. | 1×10-12mol/L | C. | 1×10-2 mol/L | D. | 1×10-7 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L 0.1mol•L-1戊溶液中阴离子总的物质的量大于0.1mol | |
| B. | 将足量甲加入到酚酞试液中,溶液先变红后褪色 | |
| C. | X与W构成的化合物、戊、己均为离子化合物 | |
| D. | W的简单离子半径大于Z的简单离子半径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com