
| m |
| M |
| n |
| V |
| 4.6g |
| 23g/mol |
| 0.2mol |
| 0.1L |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
| 盐酸体积(mL) | 8 | 15 | 20 | 50 | x | 120 | 150 |
| 生成CO2体积(mL) | 0 | 112 | 224 | 896 | 2240 | 2240 | 2240 |
查看答案和解析>>
科目:高中化学 来源:2014届河北省高一上学期二调考试化学试卷 题型:选择题
将4.6g金属钠投入到足量水中,得到ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液。若水的质量与盐酸的质量相等,则反应后两溶液的质量关系式是( )
A.
a=b B. a b C. a
b C. a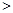 b D. 无法判断
b D. 无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com