
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 氧化铝与盐酸:O2-+2H+═H2O | |
| C. | NaOH溶液与小苏打溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- |
分析 A.电荷不守恒;
B.氧化物不能拆;
C.二者反应生成碳酸钠和水;
D.次氯酸为弱酸应保留化学式.
解答 解:A.钠与水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.氧化铝与盐酸,离子方程式:Al2O3+6H+═3H2O+2Al3+,故B错误;
C.NaOH溶液与小苏打溶液反应,离子方程式:HCO3-+OH-═CO32-+H2O,故C正确;
D.氯气通入水中,离子方程式:Cl2+H2O?H++Cl-+HClO,故D错误;
故选:C.
点评 本题考查了离子方程式正误判断,明确离子方程式书写方法是解题关键,注意离子方程式遵循客观事实、遵循原子个数、电荷数守恒规律,注意化学式的拆分,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
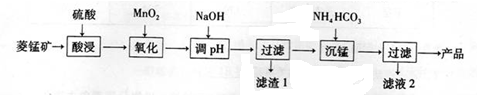
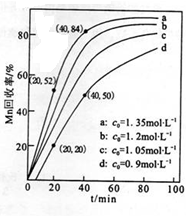
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 燃料电池中燃料都在负极发生氧化反应 | |
| C. | Fe3O4俗称铁红,常作红色油漆和涂料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
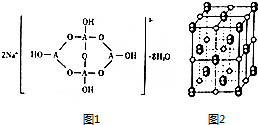 已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题:
已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题: .
.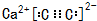 ,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).
,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
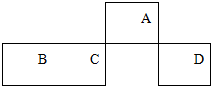 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )| A. | C元素在地壳中的含量仅次于氧元素 | |
| B. | 最高价氧化物对应水化物的酸性:C<D | |
| C. | 元素A与元素B形成的化合物BA是一种新型无机非金属材料 | |
| D. | 实验室可用B的单质与A元素最高价氧化物对应的水化物反应制取氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
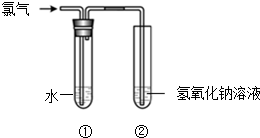 某同学用如图所示装置制取氯水并进行相关实验.
某同学用如图所示装置制取氯水并进行相关实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com