
工业催化剂K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备:
2FeC2O4·2H2O + H2O2+ 3K2C2O4+ H2C2O4=2K3[Fe(C2O4)3]·3H2O
(1)[Fe(C2O4)3]3-的名称是_______________。
(2)制备过程要防止草酸被H2O2氧化,写出草酸被H2O2氧化的化学方程式_________。
(3)配合物的稳定性可以用稳定常数K来衡量,如Cu2+ + 4NH3 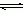 [Cu(NH3)4]2+,其稳定常数表达式为:
[Cu(NH3)4]2+,其稳定常数表达式为: 。已知K [Fe(C2O4)3]3-=1020,K [Fe(SCN)3]= 2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素? (填“是”、“否”)。 若选“否”,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案。__________________________。
。已知K [Fe(C2O4)3]3-=1020,K [Fe(SCN)3]= 2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素? (填“是”、“否”)。 若选“否”,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案。__________________________。
(4)铁元素可形成多种配合物,其中一种配合物钾盐A是有争议的食品添加剂。经组成分析A仅含K、Fe、C、N四种元素。取36.8g A加热至400℃,分解成KCN、Fe3C、C、N2,生成的氮气折合成标准状况下的体积为2.24L,Fe3C质量是C质量的3倍,Fe3C物质的量是氮气物质的量的1/3。则A的化学式为____________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
调查发现,近年来,随着建筑装潢材料进入百姓家庭,某些装修不久的居室中由装潢材料缓慢释放出来的污染物浓度过高,影响人体健康。这些污染物中最常见的是( )
A.一氧化碳 B.二氧化硫
C.臭氧 D.甲醛、甲苯等有机物蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
一个体重50 kg的健康人含铁元素 2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+ 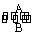 Fe3+。
Fe3+。
在过程A中,Fe2+作 剂。
维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有 性。
(2)某些补铁剂的成分是硫酸亚铁,长期放置会因氧化而变质。检验硫酸亚铁是否变质的试剂是______________(填序号)。
①稀盐酸 ②石蕊溶液 ③KSCN溶液
(3)要除去FeCl3溶液中少量的氯化亚铁,可行的办法是 (填字母)。
a.加入铜粉 b.加入铁粉 c.通入氯气 d.加入Na OH溶液
OH溶液
根据选用的试剂,写出该过程中发生反应的离子方程式 。
(4)电子工业常用30%的FeCl3 溶液腐蚀铜箔,制造印刷线路板,写出FeCl3 与金属铜反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将同温同压下的NO、NO2、O2三种气体按以下体积比混合后通入水中,气体不能完全溶于水的是
A.1∶2∶1 B.1∶1∶1 C.5∶1∶4 D.6∶2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使紫色石蕊试剂显红色的溶液:NH4+、K+、[Al(OH)4]-、NO3-
B.稀HNO3溶液: Na+、Mg2+、SO42-、Cl-
C.FeCl3溶液:K+、Na+、I-、SO42-
D.由水电离产生的c(H+)=10-13 mol·L-1的溶液:K+、Na+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
用海带灰制备单质碘的实验中,涉及的操作正确且能达到实验目的的是( )
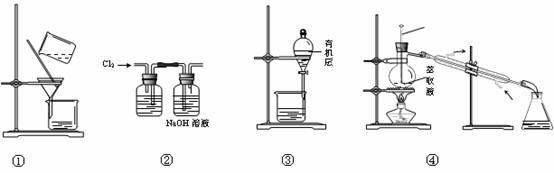
A.用图①所示装置,过滤海带灰浸取液
B.用图②所示装置,在滤液中通入Cl2
C.用图③所示装置,先放出下层液体,再放出有机层
D.用图④所示装置,回收萃取剂苯并获得单质碘
查看答案和解析>>
科目:高中化学 来源: 题型:
某Na2CO3、NaAlO2的混合溶液中逐滴
加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。请根据图像推断,下列说法中不正确的是(已知HCO3-与AlO2-在溶液中不能共存)
A.M点时生成的CO2为0 mol
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
C.V1:V2=1:4
D.a段表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓

查看答案和解析>>
科目:高中化学 来源: 题型:
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Z与X形成只含一个中心原子的共价化合物,则它的分子式是 ,其分子的立体结构是 。
(2)Y的最高价氧化物晶体类型是 晶体。X的氧化物与Y的最高氧化物中,分子极性较小的是(填分子式) 。
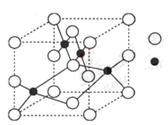
(3)右图是W的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。(图中实心球表示W元素)
(4)铜元素和W元素都位于周期表的ds区,胆矾
CuSO4·5H2O可写成[Cu(H2O)4]SO4 ·H2O,其结构示意图如右,有关它的说法正确的是 ________(填字母)。
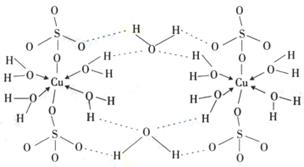
A.该胆矾晶体中存在配位键、共价键和离子键
B.该结构中还存在金属键,极性共价键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com