
| 实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
| Ⅰ | 5% | 2.0g | 20℃ | |
| Ⅱ | 5% | 1.0g | 20℃ | |
| Ⅲ | 10% | 1.0g | 20℃ | |
| Ⅳ | ω | 2.0g | 30℃ |
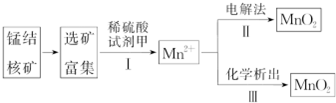
分析 工业上从锰结核矿中制取纯净的MnO2工艺流程中,先选矿富集,锰结核矿为锰的氧化物与其它金属氧化物的混合物,加入稀硫酸和试剂甲发生反应生成Mn2+,说明发生了氧化还原反应生成锰离子,则甲为还原剂,步骤Ⅱ电解法将锰离子氧化成二氧化锰,该反应应在电解池的阳极发生,步骤Ⅲ在溶液中加入KClO3反应,将锰离子氧化成生成MnO2,
(1)步骤I中,Mn元素的化合价由+4价降低为+2价;
(2)用惰性材料作电极,电解硫酸锰溶液制二氧化锰,阳极上锰离子发生氧化反应生成二氧化锰,步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol•L-1 的NaClO3溶液200mL,利用电子守恒确定还原产物,以此书写离子反应;
(3)用100mL 12.0mol•L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气,当浓盐酸变为稀盐酸时,反应就会停止,MnSO4溶液吸收氯气,获得Mn2O3,还生成硫酸和盐酸,以此书写反应方程式;
(4)①比较实验Ⅱ和Ⅲ的数据可知,两个实验中双氧水溶液浓度和实验温度都是相同的,只有二氧化锰的质量不同,据此答题;
②利用实验Ⅰ和Ⅳ探究温度对化学反应速率的影响,比较实验Ⅰ和Ⅳ的数据可知,两个实验的二氧化锰的质量相同,温度不同,则双氧水的浓度也应该相同,可判断反应的快慢,可以通过收集相同体积的气体所需要的时间判断,据此答题.
解答 解:(1)步骤I中,Mn元素的化合价由+4价降低为+2价,则试剂甲应具有还原性,故答案为:D;
(2)用惰性材料作电极,电解硫酸锰溶液制二氧化锰,阳极上锰离子发生氧化反应生成二氧化锰,电极反应式为Mn2+-2e-+2H2O═MnO2↓+4H+,步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol•L-1 的NaClO3溶液200mL,设还原产物中Cl的化合价为x,则由电子守恒可知,0.05mol×(4-2)=0.1mol/L×0.2L×(5-x),解得x=0,即生成氯气,则离子反应为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+,
故答案为:Mn2+-2e-+2H2O═MnO2↓+4H+;2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+;
(3)用100mL 12.0mol•L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气,当浓盐酸变为稀盐酸时,反应就会停止,反应中氯化氢的最大物质的量为100mL×12.0mol•L-1=1.2mol,所以产生的氯气在标准状况下体积最大值为$\frac{1}{4}$×1.2mol×22.4L/mol=6720mL,而实际上产生的氯气的体积小于6720mL,工业上可用MnSO4溶液吸收氯气,获得Mn2O3,还生成硫酸和盐酸,该反应为2Mn2++Cl2+3H2O═Mn2O3+6H++2Cl-,
故答案为:V(Cl2)<6720mL;2Mn2++Cl2+3H2O═Mn2O3+6H++2Cl-;
(4)①比较实验Ⅱ和Ⅲ的数据可知,两个实验中双氧水溶液浓度和实验温度都是相同的,只有二氧化锰的质量不同,所以可通过这两个实验得出的结论为:其他条件不同,反应物浓度越大,反应速率越快,
故答案为:其他条件不同,反应物浓度越大,反应速率越快;
②利用实验Ⅰ和Ⅳ探究温度对化学反应速率的影响,比较实验Ⅰ和Ⅳ的数据可知,两个实验的二氧化锰的质量相同,温度不同,则双氧水的浓度也应该相同,即ω=5%,根据收集相同体积的气体所需要的时间可以判断反应的快慢,所以本实验待测数据是收集等体积氧气所需要的时间,
故答案为:5%;收集等体积氧气所需要的时间.
点评 本题以二氧化锰的制取为载体,主要考查了物质性质和实验基本操作的理解应用,氧化还原反应产物的分析等,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
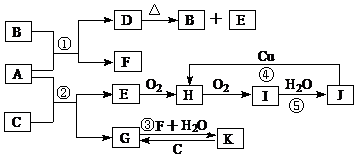
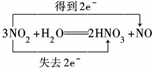 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
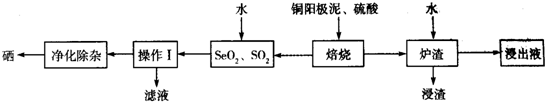

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
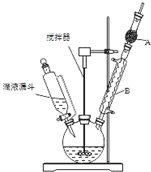 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
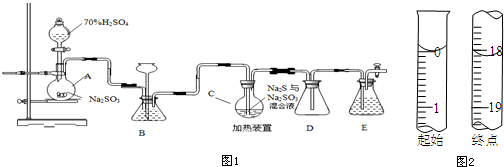
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
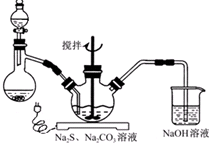 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题: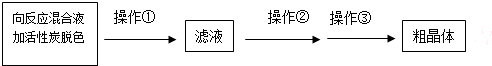
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
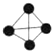 ),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | 1molN4气体完全转变为N2将放出882kJ热量 | |
| B. | 14N2与15N2互为同位素,N4与N2互为同素异形体 | |
| C. | N4属于一种新型的化合物 | |
| D. | 14N与15N化学性质不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变温度和使用催化剂都能改变化学反应速率 | |
| B. | 利用丁达尔效应可以区别FeCl3溶液和Fe(OH)3胶体 | |
| C. | 根据△G=△H-T△S推测:△H<0的化学反应都可以自发进行 | |
| D. | 将AlCl3溶液蒸干并灼烧,所得固体为Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com