
����Ŀ������Ҫ����500 mL 1 mol��L��1������Һ��
��1������ȡ��������Ϊ98%���ܶ�Ϊ1.84 g��cm��3��Ũ����________mL��
�����²������裺
�ٰ����õ�Ũ�������ձ�������ע������ˮ�У����ò����������ܽ⡣
�ڰѢ�������Һ��ȴ��С��ת��500mL����ƿ�С�
�ۼ���������ƿ�м�����ˮ��Һ���̶���1��2cm�������ý�ͷ�ι�С�ĵμ�����ˮ����Һ��Һ��ײ���̶������С�
������������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ��ϴ�ӵ�Һ�嶼С��ת������ƿ��������ҡ�ȡ�
�ݽ�����ƿ�����������ҡ�ȡ�
����д���пհף�
��2�������������ȷ˳��Ϊ______________(�����)��
��3����ʵ������õ��IJ���������10ml��Ͳ�����������ձ���_________��
��4���������ʹ������Һ��Ũ��ƫ�ߵ���_________
A.ijͬѧ�۲�Һ��������ͼ��ʾ

B.û�н��в�������ܣ�
C.������ˮʱ���������˿̶��ߣ�������һ����ˮ��
D.������ƿ��ת����Һʱ(���������)��Һ��������ƿ����
��5����ʵ������г���(4)��Dѡ�����Ӧ��δ�������________
���𰸡�2.7 �٢ڢܢۢ� 500mL����ƿ����ͷ�ι� A ��������
��������
��1������ϡ�������������������������ҪŨ����������
��2������һ�����ʵ���Ũ����Һ��һ�㲽�裺��������ȡ��ϡ�͡���ȴ����Һ��ϴ����������ҡ����װƿ��ǩ���ݴ�����
��3����������һ�����ʵ���һ�㲽��ѡ����Ҫ������
��4���������������ʵ����ʵ�������Һ�����Ӱ�죬����c=![]() ������������
������������
��5�������������ʵ��ʧ���������ȵģ���Ҫ�������ơ�
��1����98%��Ũ����(��=1.84g/cm3)����500mL 1molL1H2SO4��Һ�����ƹ�����������������䣬����ҪŨ��������Ϊx mL��
��1.84g/cm3��x mL��98%=1mol/L��0.5L��98g/mol����ã�x��2.7���ʴ�Ϊ��2.7��
��2�����Ƹ�ϡ����IJ���Ϊ����������ȡ��ϡ�͡���ȴ����Һ��ϴ����������ҡ�ȵȣ�������������ȷ˳��Ϊ���٢ڢܢۢݣ�
��3��������Һ�IJ������裺���ȼ������Ҫ�����ʵ�������Ȼ����ƽ������������ձ����ܽ⣬ͬʱ�ò��������裬����Һ��ȴ�����º��ò�����������Һ��500ml����ƿ��Ȼ��ϴ���ձ��Ͳ�����2��3�Σ���ϴ��ҺҲע������ƿ��Ȼ��������ƿ��עˮ����Һ����̶���1��2 cmʱ�����ý�ͷ�ι���μ��룬����Һ����̶������У�Ȼ��ҡ�ȡ�װƿ���ڴ˹������õ��������У���ƽ��ҩ�ס��ձ�����������500ml����ƿ����ͷ�ιܣ���ȱ�ٵ�������500mL����ƿ����ͷ�ιܣ�
��4��A. ͼ��Ϊ���ӿ̶���,������Һ���ƫС,����c=n/V��֪��ҺŨ��ƫ�ߣ�A����ȷ��
B. û�н��в�������ܣ����²���������ģ����ʵ�������ƫС����ҺŨ��ƫ�ͣ�B�����
C. ������ˮʱ���������˿̶ȣ�������Һ���ƫ����ҺŨ�Ȼ�ƫ�ͣ�C�����
D. ������ƿ��ת����Һʱ(ʵ�鲽���)������Һ�ε�������ƿ���棬�������ʵ����ʵ���ƫС����ҺŨ�Ȼ�ƫ�ͣ�D�����
��ΪA��
��5��������ƿ��ת����Һʱ(���������)��Һ��������ƿ���棬���ʼ�С������ʵ��ʧ���������ȣ������������ƣ��ʴ�Ϊ���������ơ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��һ�㺬��п����������������ʣ�����ͼ3��ʾװ���У��׳ص��ܷ�Ӧ����ʽΪ��C2H5OH+3O2+4KOH��2K2CO3+5H2O ��ͨ��·һ��ʱ���Cu�缫����������6.4 g���ڴ˹����У�����˵����ȷ����
A. ��������A��D��C��B
B. �ҳ�����ͭ��Һ��Ũ�Ȳ���
C. �׳���������2.24 L
D. �׳ظ�����ӦʽΪC2H5OH-12e��+16OH��=2CO32��+11H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫���200mL KCl��CuSO4�Ļ����Һ,����һ��ʱ��������ֱ�õ�11.2L����״���£����塣ԭ�����Һ��KCl�����ʵ���Ũ�Ȳ�����Ϊ
A. 5mol/L B. 4mol/L C. 2.5mol/L D. 1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ-��ѡ��3�����ʽṹ������]������������־����־�����������й��ڰ�ͭ�ļ��أ���������ͭ��ͭ���Ͻ��������⣬����Ҫ������ң������������������Ʒ���ش��������⣺
��1����Ԫ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ_________��3d�ܼ��ϵ�δ�ɶԵĵ�����Ϊ______��
��2�����������ڰ�ˮ�γ�[Ni(NH3)6]SO4��ɫ��Һ��
��[Ni(NH3)6]SO4�������ӵ����幹����_____��
����[Ni(NH3)6]2+��Ni2+��NH3֮���γɵĻ�ѧ����Ϊ______���ṩ�µ��ӶԵijɼ�ԭ����_____��
�����ķе㣨����������������������좣�PH3����ԭ����______������_____���ӣ����������������Ǽ�������������ԭ�ӵĹ���ӻ�����Ϊ_______��
��3������ͭ����������______���γɵľ��壺Ԫ��ͭ�����ĵڶ������ֱܷ�Ϊ��ICu=1959kJ/mol��INi=1753kJ/mol��ICu>INi��ԭ����______��
��4��ij����ͭ�Ͻ�����������ṹ��ͼ��ʾ��
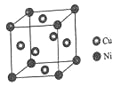
��������ͭԭ������ԭ�ӵ�������Ϊ_____��
�����Ͻ���ܶ�Ϊdg/cm3����������a=________nm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֬�ް�סԼ0.2g�������Ʒ�ĩ������ʯ�����ϣ�����֬���ϵ�ˮ���۲쵽��֬����ȼ�ա�
(1)������ʵ���������ó����йع������Ƹ�ˮ��Ӧ�Ľ����ǣ������������ɣ���____________��Na2O2��ˮ��Ӧ�Ļ�ѧ����ʽ��____________��
(2)ij�о���ѧϰС��������ͼ��ʾװ��(����������)����ʵ�飬��֤���������ۡ�������֤��һ�����۵�ʵ�鷽����_________��������֤�ڶ������۵�ʵ�鷽����________��

(3)��ҵ�Ͻ�����ͨ��ʯ����[Ca(OH)2]��ȡƯ�ۣ���ѧ����ʽΪ____��
(4)��Cl2�Ƴ�Ư�۵���ҪĿ����________(����ĸ)��
A.��ǿƯ����������������
B.ʹ��ת��Ϊ���ȶ����ʣ����ڱ��������
C.ʹ��ת��Ϊ��������ˮ������
D.����ȵ�����������������Ư�ס�����
(5)��Ư����������ˮ�У��ʰ�ɫ��״����ó�����ȡ�����ϲ���Һ���μ�̼������Һ���ְ�ɫ������������Ӧ�Ļ�ѧ����ʽΪ_________��
(6)ƿװƯ�۾��ÿ����л��ϡ��״��ʧȥƯ�����á����û�ѧ����ʽ��ʾƯ���ڿ�������ʧЧ��ԭ���Ǣ�_____________����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���ѧ��Ӧ��Ϊ�˸��õ����û�ѧ��Ӧ���ش��������⣺
��1���ڢ��û���Ӧ �ڻ��Ϸ�Ӧ �۷ֽⷴӦ �ܸ��ֽⷴӦ���ֻ�����Ӧ�����У�һ������������ԭ��Ӧ����____(����)��
��2�������з�Ӧ�У�K2Cr2O7+14HCl==2KCl+2CrCl3+3Cl2��+7H2O��___����������___Ԫ�ر�������___�ǻ�ԭ���___�����������˫���ű�������ת�Ƶķ������Ŀ��____��
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2��+7H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2(g)��Cl2(g)![]() 2HCl(g)�ķ�Ӧ�����仯ʾ��ͼ���¡�����˵������ȷ����
2HCl(g)�ķ�Ӧ�����仯ʾ��ͼ���¡�����˵������ȷ����

A. ���Ķ��ѹ��������ȹ��̣������γɹ����Ƿ��ȹ���
B. ��������м���������������������ʼ̬H2��Cl2��������
C. ��Ӧ����H��[(a+b)-2c]kJ/mol
D. ��ȼ�������������£���Ӧ����H��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������������ȷ���ǣ� ��
A. 64 g SO2������ԭ����Ϊ1NA
B. ���ʵ���Ũ��Ϊ0.5 mol��L��1��MgCl2��Һ������Cl����Ϊ1 NA
C. ��״���£�22.4 L H2O�ķ�����Ϊ1NA
D. ���³�ѹ�£�14 g N2���з�����Ϊ0.5 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���a L H2��Cl2�Ļ�������ȼ����ַ�Ӧ���������ͨ�뺬b mol NaOH������Һ�У�����ǡ�ñ���ȫ���գ�NaOH��ʣ�࣬��÷�Ӧ����Һ�к�Cl����ClO����![]() �����������ʵ���֮��Ϊ8��1��1����ԭ���������H2�����ʵ���Ϊ(����)
�����������ʵ���֮��Ϊ8��1��1����ԭ���������H2�����ʵ���Ϊ(����)
A. ![]() mol B.
mol B. ![]() mol C.
mol C. ![]() mol D.
mol D. ![]() mol
mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com