
| A. | NaOH+HCl与KOH+CH3COOH | B. | NaOH+H2SO4与 Ba(OH)2+H2SO4 | ||
| C. | BaCl2+H2SO4与Ba(OH)2+Na2SO4 | D. | CaCO3+H2SO4 与Na2CO3+HCl |
分析 A.氯化氢为强电解质,应拆成离子形式;醋酸为弱电解质,应保留化学式;
B.前者反应实质为氢离子与氢氧根离子反应生成水,后者反应实质氢离子与氢氧根离子反应生成水,钡离子与硫酸根离子反应生成硫酸钡沉淀;
C.二者反应实质都是钡离子与硫酸根离子反应生成硫酸钡沉淀;
D.碳酸钙为沉淀应保留化学式,碳酸钠为可溶性盐应拆成离子形式.
解答 解:A.氯化氢为强电解质,应拆成离子形式;醋酸为弱电解质,应保留化学式,二者都与氢氧化钠反应不能用同一个离子方程式表示,故A错误;
B.前者反应实质为氢离子与氢氧根离子反应生成水,后者反应实质氢离子与氢氧根离子反应生成水,钡离子与硫酸根离子反应生成硫酸钡沉淀,二者反应实质不同,所以不能用同一个离子方程式 表示,故B错误;
C.二者反应实质都是钡离子与硫酸根离子反应生成硫酸钡沉淀,都可以用离子方程式:Ba2++SO42-=BaSO4↓,故C正确;
D.碳酸钙为沉淀应保留化学式,碳酸钠为可溶性盐应拆成离子形式,二者不能用同一个离子方程式表示,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,题目难度不大,解题时应注意化学式的拆分、反应物用量对反应的影响,注意离子方程式的意义.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向氨水中加入氢氧化钠或氯化铵都能使氨水的电离平衡逆向移动,一水合氨的电离常数减小 | |
| C. | 向氯水中加入CaCO3可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1HF溶液加水稀释,其电离平衡常数和$\frac{c({H}^{+})}{c(HF)}$均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)+H2(g)?CH3CH2CH2CH3(g)△H1
(g)+H2(g)?CH3CH2CH2CH3(g)△H1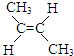 (g)+H2(g)?CH3CH2CH2CH3(g)△H2
(g)+H2(g)?CH3CH2CH2CH3(g)△H2| 温度(℃) | 300 | 320 | 340 |
| K1 | 4.8×10-4 | 2.5×10-4 | 1.3×10-4 |
| K2 | 8.4×105 | 3.5×103 | 1.6×103 |
 (g)→
(g)→ (g)△H
(g)△H
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
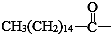 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的( )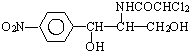
| A. | 无味氯霉素的分子式为:C27H44O6N2Cl2 | |
| B. | 它的水溶性变差,所以苦味消失 | |
| C. | 它是棕榈酸的盐类 | |
| D. | 它的水溶性变良,所以苦味消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在熔融状态下的电离方程为:NaHSO4═Na++H++SO42- | |
| B. | 在0.1m0L,L-1醋酸中加水,可使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 升温可使电离平衡NH3•H2O?NH4++OH-向左移动 | |
| D. | 向氯水中加人少量氢氧化钠溶液可使溶液中的c(HClO)增大 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
将1 000 mL 0.1 mol·L-1BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1 000 mL 0.5 mol·L-1HCl溶液与足量CH3COONa溶液充分反应放出b kJ 热量(不考虑醋酸钠水解);将500 mL 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
热量(不考虑醋酸钠水解);将500 mL 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
A.(5a-2b) kJ B.(2b-5a) kJ C.(10a+4b)kJ D.(5a+2b)kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com