
【题目】如图是四种常见有机物的比例模型,请回答下列问题:

(1)向丙中加入溴水,振荡静置后,观察到溶液分层,上层为_______色。
(2)甲的同系物的通式为CnH2n+2,当n=5时,写出含有3个甲基的有机物的结构简式_____。
下图是用乙制备D的基本反应过程

(3)A中官能团为__________。
(4)反应①的反应类型是__________。
(5)写出反应④的化学方程式_______。
(6)现有138gA和90gC发生反应得到80gD。试计算该反应的产率为______(用百分数表示,保留一位小数)。
【答案】橙红(或橙) ![]() —OH (或羟基) 加成反应 CH3COOH+CH3CH2OH
—OH (或羟基) 加成反应 CH3COOH+CH3CH2OH ![]() CH3 COOCH2CH3+H2O 60.6%
CH3 COOCH2CH3+H2O 60.6%
【解析】
由四种常见有机物的比例模型可知,甲为CH4,乙为乙烯,丙为苯,丁为CH3CH3OH。乙烯与水反应生成乙醇,乙醇氧化生成乙醛,乙醛氧化生成乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯,乙醇D为乙酸乙酯,结合四种物质的结构和性质分析解答。
(1)苯的密度比水小,溴易溶于苯,上层溶液颜色为橙红色(或橙色),下层为水层,几乎无色,故答案为:橙红(或橙);
(2)当n=5时,分子中含有3个甲基,则主链有4个C原子,应为2-甲基丁烷,结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)乙烯与水反应生成乙醇,乙醇氧化生成乙醛,乙醛氧化生成乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯,乙醇D为乙酸乙酯,因此A为乙醇,含有的官能团为-OH (或羟基),故答案为:-OH(或羟基);
(4)反应①为乙烯与水的加成反应,故答案为:加成反应;
(5)反应④为乙醇和乙酸的酯化反应,反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(6)138g乙醇的物质的量为![]() =3mol,90g乙酸的物质的量为
=3mol,90g乙酸的物质的量为![]() =1.5mol,则乙酸完全反应,可得1.5mol乙酸乙酯,质量为132g,而反应得到80g乙酸乙酯,则反应的产率为
=1.5mol,则乙酸完全反应,可得1.5mol乙酸乙酯,质量为132g,而反应得到80g乙酸乙酯,则反应的产率为![]() ×100%=60.6%,故答案为:60.6%。
×100%=60.6%,故答案为:60.6%。


科目:高中化学 来源: 题型:
【题目】碘化亚铜(CuⅠ)是阳极射线管覆盖物,不溶于水和乙醇。下图是工业上由冰铜制取无水碘化亚铜的流程。

(1)FeS中S的化合价为_____________。
(2)步骤①中Cu2S被转化为Cu,同时有大气污染物A生成,相关化学反应方程式为_____________,熔渣B的主要成分为黑色磁性物质,其化学式为_____________。
(3)步骤②中H2O2的作用是_____________;步骤③中加入过量NaI涉及的主要离子反应方程式为_____________。
(4)步骤④用乙醇洗涤的优点是_____________;检验沉淀是否洗涤干净的方法是_____________。
(5)溶液I中通常含少量Fe(Ⅲ)。已知该工业条件下,Fe(OH)3的Ksp=1.0×10-38,据此分析除去Fe(Ⅲ)(即c(Fe3+)≤1.0×10-5mol/L)应调节pH不小于_____________(水的离子积以常温计)。
(6)准确称取 m g CuI样品,加入足量的Fe2(SO4)3溶液,发生反应为2CuⅠ+4Fe3+===2Cu2++4Fe2++I2,待样品完全反应后,用amol/L酸性KMnO4溶液滴定Fe(Ⅱ),消耗标准液的体积平均值为ⅴmL。样品中CuI的质量分数的计算表达式为_____________;如果滴定前,酸式滴定管没有用标准液润洗,CuI的质量分数_____________(填“偏低”、“偏高”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物“利尿酸”是一种常见的兴奋剂,其分子结构如下图,下列说法正确的是
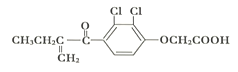
A. 利尿酸是芳香烃
B. 利尿酸与AgNO3溶液反应有白色沉淀生成
C. 一定条件下,利尿酸能发生取代反应、加成反应和酯化反应
D. 1mol利尿酸与饱和碳酸钠溶液反应能放出1 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组用高锰酸钾粉末与浓盐酸制取氯气,并验证其性质。

(资料在线)高锰酸钾粉末与浓盐酸混合即产生氯气。
请回答下列问题:
(1)该实验中A部分的装置应选用下图中的______(填序号)

(2)实验中A发生反应的离子方程式是_________。
(3)一段时间后D中的现象为_________。
(4)请你设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤) _________。
(5)图(1)整套实验装置存在的明显缺陷是_________。
(6)图(2)装置a处通入氯气,证明氯气是否具有漂白性,该设计能否达到实验目的? _________ (填“能”或“不能”)。若能请说明理由,若不能则提出改进的措施_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2=CHCH2C1) ,反应原理为
i.CH2=CHCH,3(g)+Cl2(g)![]() CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
ii.CH2=CHCH,3(g)+Cl2(g)![]() CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
已知:相关化学键的键能数据如下表所示:
化学键 | C=C | C—C | C—Cl | Cl—Cl |
E/( kJ mol-1) | 611 | x | 328 | 243 |
请回答下列问题:
(1)由反应i计算出表中x=_____________。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHC1CH3的产率______(填“增大”“减小”或“不变”),理由是_________________________________。
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HC1,只发生反应CH2=CH CH2Cl (g)+HCl(g)![]() CH2ClCHClCH3(g) ΔH3。 5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
CH2ClCHClCH3(g) ΔH3。 5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
①平衡时,HCl的体积分数为_________(保留三位有效数字)。
②保持其它条件不变,6 min时再向该容器中充入0.6 mol CH2=CHCH2Cl、0.2molHC1和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)___ V逆(HCl) (填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体说法的正确组合是
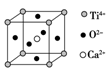
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1
B. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
C. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1
D. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com