
分析 (1)由两种或以上物质构成的是混合物;阴离子是酸根离子、阳离子是金属离子或铵根离子的化合物是盐;
(2)在水溶液中或熔融状态下能自身电离出自由移动离子而导电的化合物为电解质;物质由自由移动的离子或电子则能导电;
(3)稀盐酸中的H+有氧化性,故能和具有还原性的物质发生氧化还原反应,据此分析.
解答 解:(1)由两种或以上物质构成的是混合物,故④空气、⑥稀硫酸是混合物;阴离子是酸根离子、阳离子是金属离子或铵根离子的化合物是盐,故②硝酸钾晶体、⑤熔融氯化钠是盐,故答案为:④⑥; ②⑤;
(2)在水溶液中或熔融状态下能自身电离出自由移动离子而导电的化合物为电解质,①二氧化碳在水溶液和熔融状态下均不能导电,故不是电解质; ②硝酸钾晶体在水溶液和熔融状态下均能导电,故为电解质; ③铝是单质,故不是电解质; ④空气是混合物,故不是电解质; ⑤熔融氯化钠能导电,故为电解质; ⑥稀硫酸是混合物,故不是电解质; ⑦氢氧化钠固体在水溶液中和熔融状态下均能导电,故是电解质;物质由自由移动的离子或电子则能导电,而③铝 中有自由移动的电子,⑤熔融氯化钠 ⑥稀硫酸中有自由移动的离子,故均能导电,故答案为:②⑤⑦;③⑤⑥;
(3)稀盐酸中的H+有氧化性,故能和具有还原性的物质发生氧化还原反应,而这七中物质中,只有③铝有还原性,故铝和稀盐酸能发生氧化还原反应,离子方程式为:2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑.
点评 本题考查了电解质、盐和混合物以及物质能否导电的判断和离子方程式的书写,应注意的是电解质不一定能导电,能导电的也不一定是电解质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | C3H4+5O2$\stackrel{点燃}{→}$3CO2+4H2O | |
| B. | Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O | |
| C. | CaCO3$\stackrel{高温}{→}$CaO+CO2↑ | |
| D. | mH2O+nCO2$→_{叶绿素}^{光}$Cm(H2O)m+nO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列命名正确的是( )
,下列命名正确的是( )| A. | 2,3,4-三甲基己烷 | B. | 2,3-二甲基-4-乙基戊烷 | ||
| C. | 4-乙基-2,3-二甲基戊烷 | D. | 2-乙基-3,4-二甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中有三聚氟化氢(HF)3分子存在 | |
| B. | 冰的密度比液态水的密度小 | |
| C. | H2O的分解温度比H2S高 | |
| D. | 乙醇能与水以任意比混溶而甲醚(CH3-O-CH3)难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0℃,1.01×105 Pa时,11.2 L氮气所含原子数目为NA | |
| B. | 标准状况下,5.6 L SO3的质量约为20 g | |
| C. | 同温同压下,16 g CH4与44 g CO2具有相同的体积 | |
| D. | 标准状况下,CO和N2的密度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 | |
| B. | C3N4晶体中C-N键长比金刚石中C-C要长 | |
| C. | C3N4晶体中微粒间可能存在氢键 | |
| D. | C3N4晶体是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验方案 |  | 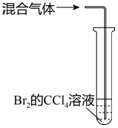 |  |  |
| 目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱,酸性依次减弱 | |
| B. | 熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 | |
| C. | NCl3分子中所有的原子均为8电子稳定结构 | |
| D. | NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com