
已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是
A.该反应中旧化学键断裂需要吸收能量,新化学键形成需要放出能量,所以总能量不变
B.上述热化学方程式中的ΔH的值与实验测定中反应物的用量无关
C.该反应的化学能可以转化为电能
D.反应物的总能量高于生成物的总能量
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高二上月考三化学试卷(解析版) 题型:选择题
将含0.4 mol/LCu(NO3)2和0.4 mol/L KCl的水溶液500 mL,用惰性电极电解一段时间后,在一个电极上析出0.15 mol Cu,此时在另一电极上放出气体,在标准状况下约为( )
)
A.5.6 L B.6.72 L C.2.8 L D.8.4 L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期中(文)化学试卷(解析版) 题型:选择题
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。下列说法不正确的是
A.淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体
B.淀粉水解的最终产物能发生银境反应
C.向蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水
D.脂肪能发生皂化反应,生成甘油和高级脂肪酸钠
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二上10月月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.Cl2通入水中:Cl2 + H2O = 2H+ + Cl— + ClO—
B.双氧水中加入稀硫酸和KI溶液:H2O2 + 2H+ + 2I— = I2 + 2H2O
C.NaHCO3溶液与稀H2SO4反应:CO2-3+2H+=H2O+CO2↑
D.Na2S2O3溶液中加入稀硫酸:2S2O32— +4H+ = SO42— + 3S↓ + 2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二上10月月考化学试卷(解析版) 题型:选择题
某反应过程能量变化如图所示,下列说法正确的是
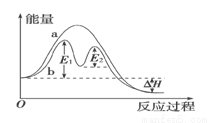
A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,不能改变该反应的活化能
D.有催化剂条件下,反应的活化能等于E1+E2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一上学期期中测试化学试卷(解析版) 题型:选择题
有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光现代中学高一上12月月考化学卷(解析版) 题型:选择题
能够证明溶液中一定大量存在CO32-的是( )
A.加入硝酸银溶液时有白色沉淀产生
B.加入盐酸时有无色无味气体产生,该气体能使澄清石灰水变浑浊
C.加入氯化钙溶液时有白色沉淀产生,再加稀盐酸沉淀溶解,且产生可使澄清石灰水变浑浊的无色无味气体
D.加入氢氧化钡溶液时有白色沉淀,再加稀盐酸反应现象如C
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:计算题
聚合硫酸铝铁[AlaFeb(OH)n(SO4)m·xH2O]是一种新型高效净水剂,广泛应用于工业污染水的处理。
(1)聚合硫酸铝铁能够净水的原因是
(2)AlaFeb(OH)m(SO4)n•xH2O中a、b、m、n的代数关系式为_______________________。
(3)为了测定聚合硫酸铝铁的组成,进行如下实验:
步骤一:准确称取8.810g样品溶于150mL 0.100mol•L-1稀硫酸,恰好完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体10.485g;
步骤二:另取相同质量的样品,溶于过量的氢碘酸,以磁力搅拌机搅拌,充分反应后,以0.500mol•L-1Na2S2O3溶液滴定至浅黄色,滴入几滴淀粉溶液,再滴定至终点,消耗Na2S2O3溶液20.00mL.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
①步骤二中使用磁力搅拌器进行搅拌的目的是________________________。
②通过计算确定聚合硫酸铝铁的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:填空题
电解原理在工业生产中有广泛的应用。
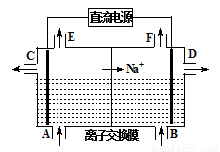
(1)如图为离子交换膜法电解饱和食盐水的原理示意图,下列说法不正确的是 。
A.直流电源的左侧为负极
B.从E口逸出的气体是H2
C.从B口加入含少量NaOH的水溶液以增强导电性
D.从C口出来的溶液为NaOH溶液
E.每生成22.4 L Cl2,便产生2 mol NaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2  O3+3H2O2。则阳极的电极反应式为 ,阴极的电极反应式为 。
O3+3H2O2。则阳极的电极反应式为 ,阴极的电极反应式为 。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液。
①高铁酸钾溶液长时间放置不稳定,会产生红色絮状物质及气泡,则该过程的离子方程式为 。
②电解制高铁酸钾时阳极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com