
| 离子 | 开始沉 淀的pH | 完全沉 淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.7 | 3.2 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9.0 |
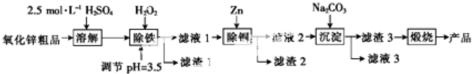
分析 由实验流程可知,氧化锌粗品(含有FeO、Fe2O3、CuO杂质),用硫酸浸出锌,得溶液中含有Fe2+、Fe3+、Cu2+、Zn2+,再加入双氧水将Fe2+氧化成Fe3+,调节pH值,使Fe3+生成滤渣1为氢氧化铁,过滤除杂,得到滤液的中加入足量的锌,置换出铜,得滤渣2为铜和过量的锌,滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌,
(1)根据配制一定物质的浓度的溶液的操作要求可知,实验过程需要用到的玻璃仪器;
(2)Na2CO3溶液中碳酸根离子发生水解,使溶液呈碱性,且一级水解程度大于二级水解;
(3)根据上面的分析可知滤渣的成份;加入H2O2时亚铁离子在酸性条件下与双氧水发生氧化还原反应生成铁离子和水;
(4)“煅烧”反应生成ZnO、二氧化碳和水.
解答 解由实验流程可知,氧化锌粗品(含有FeO、Fe2O3、CuO杂质),用硫酸浸出锌,得溶液中含有Fe2+、Fe3+、Cu2+、Zn2+,再加入双氧水将Fe2+氧化成Fe3+,调节pH值,使Fe3+生成滤渣1为氢氧化铁,过滤除杂,得到滤液的中加入足量的锌,置换出铜,得滤渣2为铜和过量的锌,滤液中含锌离子,与加 入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌,
(1)根据配制一定物质的浓度的溶液的操作要求可知,实验过程需要用到的玻璃仪器有烧杯、胶头滴管、00mL容量瓶、量筒、玻璃棒,
故答案为:00mL容量瓶、量筒、玻璃棒;
(2)Na2CO3溶液中碳酸根离子发生水解,使溶液呈碱性,且一级水解程度大于二级水解,所以pH=12的Na2CO3溶液中阴离子的浓度由大到小的顺序为c(CO32-)>c(OH-)>c(HCO3-),
故答案为:c(CO32-)>c(OH-)>c(HCO3-);
(3)根据上面的分析可知滤渣1为氢氧化铁,化学式为Fe(OH)3,滤渣2为Cu、Zn,加入H2O2时亚铁离子在酸性条件下与双氧水发生氧化还原反应生成铁离子和水,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:Fe(OH)3;Cu、Zn;2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)“煅烧”反应生成ZnO、二氧化碳和水,反应为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑,
故答案为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
点评 本题考查学生对工艺流程的理解、阅读获取信息能力、对操作步骤的分析评价、物质的分离提纯、氧化还原反应计算等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力,题目难度中等.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下11.2L CO2和0.5 molCO2 | |
| B. | 18 mL H2O和2x10Pa,27C 16gO2 | |
| C. | 1 molCO和88gCO2 | |
| D. | 27℃,22.4 LCl2和含4mol氧原子的H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 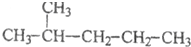 和 和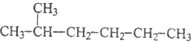 | |
| B. | CH3-CH2NO2和H2N-CH2-COOH | |
| C. | CH2═CH-CH2-COOH和CH3-CH═CH-COOH | |
| D. | CH3-CH2-O-CH2-CH3和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti核外电子数相等 | |
| C. | 分别由${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti组成的金属钛单质互称为同位素 | |
| D. | ${\;}_{22}^{48}$Ti与${\;}_{22}^{50}$Ti为同一核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
| A | Fe3+、S2ˉ、Clˉ、Na+ | NaOH溶液 | Fe3++3OHˉ═Fe(OH)3↓ |
| B | H+、Fe2+、SO42ˉ、NO3ˉ | BaCl2溶液 | SO42ˉ+Ba2+═BaSO4↓ |
| C | Na+、Al3+、Clˉ、SO42ˉ | 少量KOH溶液 | Al3++3OHˉ═Al(OH)3↓ |
| D | Na+、K+、ClOˉ、SO42ˉ | 通入少量SO2 | 2ClOˉ+SO2+H2O═2HClO+SO32ˉ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键 | B. | 分子晶体中的分子内不含有共价键 | ||
| C. | 分子晶体中一定有非极性共价键 | D. | 分子晶体中分子一定紧密堆积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,1,2,2-四甲基戊烷 | B. | 3-甲基-1,3-丁二烯 | ||
| C. | 2,4,6-三硝基甲苯 | D. | 2-甲基-3-丁醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com