

分析 J为AgCl,且溶液焰色反应呈紫色,说明含有K元素,根据元素守恒知,F为KCl;
白色沉淀G在空气中变为红色沉淀H,则G为Fe(OH)2、H为Fe(OH)3,H和稀盐酸反应生成溶液I,I溶液为棕黄色,I为FeCl3,I和A反应生成B,B溶液为浅绿色,且A为固体单质,所以A为Fe、B为FeCl2,FeCl2和Cl2反应生成FeCl3,则C为Cl2,FeCl2和E反应生成KCl和Fe(OH)2,根据元素守恒得E为KOH,结合题目分析解答.
解答 解:J为AgCl,且溶液焰色反应呈紫色,说明含有K元素,根据元素守恒知,F为KCl;白色沉淀G在空气中变为红色沉淀H,则G为Fe(OH)2、H为Fe(OH)3,H和稀盐酸反应生成溶液I,I溶液为棕黄色,I为FeCl3,I和A反应生成B,B溶液为浅绿色,且A为固体单质,所以A为Fe、B为FeCl2,FeCl2和Cl2反应生成FeCl3,则C为Cl2,FeCl2和E反应生成KCl和Fe(OH)2,根据元素守恒得E为KOH,
(1)通过以上分析知,足量气体C是Cl2,F的化学式为KCl,
故答案为:Cl2;KCl;
(2)通过以上分析知,B的化学式FeCl2,亚铁离子能使酸性高锰酸钾溶液褪色,能和铁氰化钾溶液反应生成特征蓝色沉淀,所以可以用酸性高锰酸钾溶液或铁氰化钾溶液检验亚铁离子,检验B中阳离子的操作方法是取少量B溶液于试管中,向其中滴加酸性高锰酸钾溶液,高锰酸钾溶液褪色或向其中滴加铁氰化钾溶液,溶液产生蓝色沉淀,都说明含有亚铁离子,
故答案为:FeCl2;取少量B溶液于试管中,向其中滴加酸性高锰酸钾溶液,高锰酸钾溶液褪色或向其中滴加铁氰化钾溶液,溶液产生蓝色沉淀,都说明含有亚铁离子;
(3)氢氧化亚铁不稳定,易被空气氧化生成红褐色氢氧化铁沉淀,由G转变成H的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)I为铁离子,能和KSCN溶液反应生成络合物而使溶液呈血红色,所以可以用KSCN溶液检验铁离子,则检验I溶液中阳离子的离子方程式Fe3++3SCN-=Fe(SCN)3;向I溶液中加入单质Cu的有关离子反应方程式是2Fe3++Cu=2Fe2++Cu2+,
故答案为:Fe3++3SCN-=Fe(SCN)3;2Fe3++Cu=2Fe2++Cu2+.
点评 本题考查无机物推断,为高频考点,侧重考查学生分析推断及知识综合运用能力,明确常见物质特殊颜色或新制是解本题关键,知道铁离子、亚铁离子检验方法和现象,但在检验离子时要注意化学用语的正确运用,学生在回答时易漏掉结论而导致失分.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:实验题
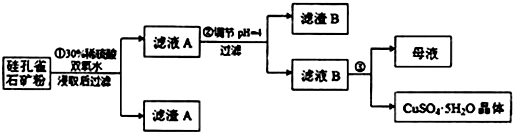
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 容量瓶的容积 | 固体质量 | 实验操作 |
| A | 480mL | 硫酸铜:7.7g | 加入500mL水 |
| B | 480mL | 胆矾:12.0g | 配成500mL溶液 |
| C | 500mL | 硫酸铜:8.0g | 加入500mL水 |
| D | 500mL | 胆矾:12.5g | 配成500mL溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使蒸发皿中的水分完全蒸干后,才能停止加热 | |
| B. | 加入盐酸,放出无色无味气体,该气体能使澄清石灰水变浑浊的气体,则原溶液中只含CO32- | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 除去铜粉中混有的少量镁粉和铝粉可加入足量氢氧化钠溶液,反应后过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64 g | B. | 32 g | C. | 1.5mol | D. | 3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用淀粉溶液检验溶液中是否存在碘单质 | |
| B. | 用分液漏斗分离乙酸乙酯与乙醇的混合物 | |
| C. | 用NaOH溶液除去乙酸乙酯中混有的乙酸 | |
| D. | 用排水集气法收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
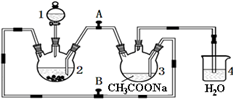 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由X→Y反应的△H=E5-E2 | |
| B. | 由X→Z反应的△H>0 | |
| C. | 由图可知等物质的量的Y的能量一定比X的能量高 | |
| D. | 升高温度可提高X→Z的反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com