
| A. | 硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体 | |
| B. | 碳在空气中燃烧,发出白光,生成使澄清石灰水变浑浊的气体 | |
| C. | 红磷在空气中燃烧,产生大量白色烟雾 | |
| D. | 将分别装有氨水和酚酞溶液的两只烧杯靠近,氨水先变红 |
分析 A.硫单质在氧气中燃烧发出蓝紫色火焰生成二氧化硫气体;
B.木炭在空气中燃烧生成二氧化碳,二氧化碳气体使澄清石灰水变浑浊;
C.红磷在空气中燃烧生成五氯化磷固体;
D.氨水显碱性,具有挥发性;
解答 解:A、硫在氧气中燃烧,发出明亮的蓝紫色火焰,产生一种具有刺激性气味的气体,故A正确.
B、碳在空气中燃烧,只能烧至红热,不会发出白光,故B错误.
C、红磷在空气中燃烧,产生大量的白烟,而不是白色烟雾,故C错误.
D、氨水显碱性,具有挥发性,将分别装有氨水和酚酞溶液的两只烧杯靠近,酚酞试液会变红色,故D错误.
故选A.
点评 本题难度不大,掌握常见物质燃烧的现象、碱的化学性质即可正确解答,在描述物质燃烧的现象时,需要注意光和火焰、烟和雾的区别.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能小于O原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B | CO2为直线形分子 | CO2分子中C为sp杂化,键角为180° |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D | HF的沸点低于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
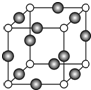 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
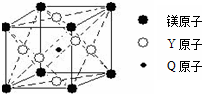 Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:| 元素 | 相关信息 |
| Q | Q的单质是实验室常用的惰性电极材料 |
| R | R原子基态时2p原子轨道上有3个未成对电子 |
| T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
| X | X是第三周期电负性最大的元素 |
| Y | 元素Y位于周期表第10列 |
| Z | Z存在质量数为65,中子数为36的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据酸分子中含有氢原子的个数,将酸分为一元酸、二元酸等 | |
| B. | 根据化合物在溶液中电离出的离子的类别,将化合物分为酸、碱、盐 | |
| C. | 根据化学反应中有无单质参加或生成,将化学反应分为氧化还原反应和非氧化还原反应 | |
| D. | 四种基本反应类型未能包括所有的化学反应,酸性氧化物、碱性氧化物、两性氧化物的分类包括了所有的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4句 | B. | 5句 | C. | 6句 | D. | 7句 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
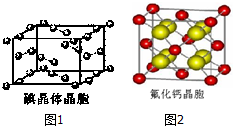 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
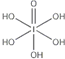 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com