
根据下列条件计算有关反应的焓变:
(1)已知:
Ti(s)+2Cl2(g)===TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)===2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)===Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知下列反应数值:
序号 | 化学反应 | 反应热 |
① | Fe2O3(s)+3CO(g)=== 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
② | 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol-1 |
③ | Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
④ | FeO(s)+CO(g)===Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4= kJ·mol-1。
(1)-970.2 (2)+7.3
【解析】(1)由已知反应得:
TiCl4(l)===Ti(s)+2Cl2(g) ΔH=+804.2 kJ·mol-1①
4Na(s)+2Cl2(g)===4NaCl(s) ΔH=-1764.0 kJ·mol-1②
4Na(s)===4Na(l) ΔH=+10.4 kJ·mol-1。③
根据盖斯定律,将①+②-③得:
TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)ΔH=+804.2 kJ·mol-1-1 764.0 kJ·mol-1-10.4 kJ·mol-1=-970.2 kJ·mol-1。
(2)根据盖斯定律,将(①×3-②-③×2)/6得:
FeO(s)+CO(g)===Fe(s)+CO2(g),则ΔH4=(ΔH1×3-ΔH2-ΔH3×2)/6≈+7.3 kJ·mol-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考名师推荐化学资源的综合应用(解析版) 题型:选择题
近年来,冠以绿色的新概念不断产生,如绿色食品、绿色能源、绿色化学等,绿色化学要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列四个方案中,你认为可行且符合“绿色化学”要求方案的是
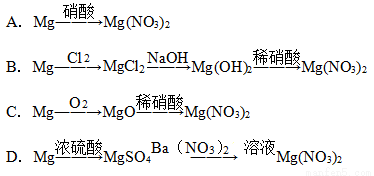
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子大量共存与推断(解析版) 题型:选择题
在水溶液中能大量共存的一组离子是
A.Fe2+、Al3+、ClO—、Cl— B.K+、Cu2+、OH、NO3—
C.NH4+、Na+、Br—、SO42— D.Mg2+、H+、SiO32-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学碳及其化合物主要性质(解析版) 题型:选择题
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如下图所示,图中AB段表示的离子方程式先后顺序正确的是

①CO2+OH-=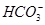 ②CO2+2OH-=
②CO2+2OH-=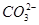 +H2O
+H2O
③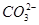 +Ba2+=BaCO3↓ ④BaCO3+CO2+H2O=Ba2++2
+Ba2+=BaCO3↓ ④BaCO3+CO2+H2O=Ba2++2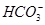
⑤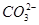 +CO2+H2O=2
+CO2+H2O=2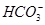
A.③① B.②⑤ C.⑤④ D.④②
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学硅及其化合物主要性质、材料(解析版) 题型:选择题
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物。下表各组物质之间通过一步反应不能实现如图所示转化的是
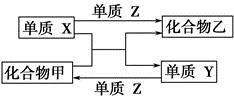
选项 | X | Y | Z | 甲 | 乙 |
A | H2 | Si | Cl2 | SiCl4 | HCl |
B | Mg | C | O2 | CO2 | MgO |
C | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
D | Cl2 | N2 | H2 | NH3 | HCl |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:选择题
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)—→C(s)+2H2(g)的ΔH是
A.-74.8 kJ·mol-1 B.+74.8 kJ·mol-1
C.-211.0 kJ·mol-1 D.+211.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
下列反应不属于水解反应或水解方程式不正确的是
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O=CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+
NH3·D2O+H+
A.①②③④ B.①②③
C.②③⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解池的工作原理、电极反应式的书写(解析版) 题型:填空题
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是
_______(填序号)。
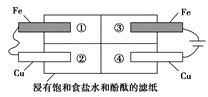
a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2OCH3CH2OH+CH3COOH
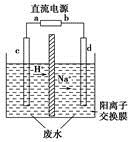
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入________(填化学式),电极反应式为________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg/L的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
钾、镁、氟、硼等元素在每升海水中的含量都大于1毫克,属于海水中的常量元素。
(1)钾、镁、氟、硼电负性从大到小的排列顺序是 。
(2)镓与硼同主族,写出镓元素原子的价电子排布式(即外围电子排布式): 。
(3)用价层电子对互斥模型推断BF3和NF3的空间构型分别为 、 。
(4)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心。由钾、镁、氟形成的该化合物的化学式为 ,每个K+与 个F-配位。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com