
【题目】甲酸香叶酯是一种食品香料,可由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )

A.香叶醇的分子式为C11H18O
B.香叶醇在浓硫酸、加热条件下可发生消去反应
C.1 mol甲酸香叶酯可以与3 mol H2发生加成反应
D.甲酸香叶酯与新制的Cu(OH)2悬浊液共热可生成红色沉淀
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产、生活中有极其广泛的用途。
(1)化学式Mg17Al12的合金是一种新型的纳米储氢合金,其储氢原来理为Mg17Al12+17H2=17MgH2+12Al,得到的混合物X(17MgH2+12Al)在一定条件下能释放出H2。
①MgH2中氢元素的化合价为____。
②将X与足量的NaOH溶液混合可得到H2,则766gX充分反应后可得到___molH2。
(2)将铝片放在汞盐溶液中,其表面会形成铝汞合金(铝表面的氧化膜被破坏了),从溶液中取出铝并放置在空气中,铝片表面会迅速长出胡须状的“白毛”(主要成分为Al2O3),同时放出大量的热.导致迅速长出“白毛”的原因可能有:一是铝、汞及介质共同形成了微小原电池,加速了铝的氧化反应;二是___。确定前一种可能原因是否存在的简单方法是___。
(3)无水AlCl3可用作有机合成的催化剂,工业上可用Al2O3、Cl2、焦炭混合反应制备无水AlCl3,该反应的另一种产物是可燃性气体,写出该反应的化学方程式:___。
(4)聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,它是应用广泛的高效净水剂。
①PAFC在强酸性和强碱性溶液中均会失去净水作用,原因是____。
②为检测PAFC中Al和Fe的含量,设计如图所示的流程:
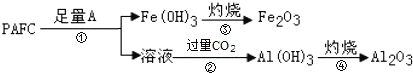
试剂A是____,步骤②中发生反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学研究小组用如图装置测定锌(含有少量铜)的纯度,下列操作能达到实验目的的是( )
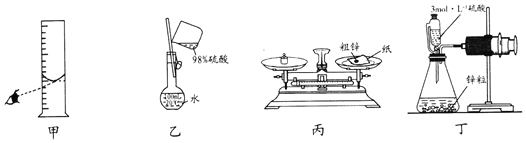
A.用装置甲量取一定体积的浓硫酸
B.用装置乙配制100mL3mo1L-1的稀硫酸
C.用装置丙称量一定质量的粗锌
D.用装置丁测量金属锌与稀硫酸反应产生氢气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子二次电池正极材料磷酸亚铁锂是应用广泛的正极材料之一。一种制备磷酸亚铁锂的化学方法为:C+4FePO4+2Li2CO3![]() 4LiFePO4+3CO2↑.回答下列问题:
4LiFePO4+3CO2↑.回答下列问题:
(1)Fe失去电子变成为阳离子时首先失去______轨道的电子。
(2)C、O、Li原子的第一电离能由大到小的顺序是______;PO43-的空间构型为______。
(3)C与Si同主族,CO2在高温高压下所形成的晶体结构与SiO2相似,该晶体的熔点比SiO2晶体______(填“高”或“低”)。硅酸盐和SiO2一样,都是以硅氧四面体作为基本结构单元,下图表示一种含n个硅原子的单链式多硅酸根的结构(投影如图1所示),Si原子的杂化类型为______,其化学式可表示为______。
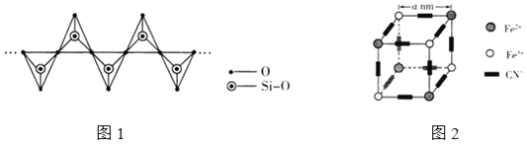
(4)图2表示普鲁士蓝的晶体结构(![]() 个晶胞,K+未标出,每隔一个立方体在立方体体心有一个钾离子)。
个晶胞,K+未标出,每隔一个立方体在立方体体心有一个钾离子)。
①普鲁士蓝晶体中每个Fe3+周围最近且等距离的Fe2+数目为______个。
②晶体中该立方体的边长为a nm,设阿伏加德罗常数为NA,其晶体密度为______gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )
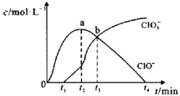
A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:c(Na+)+c(H+)=c(ClO-)+c(ClO3-)+c(OH-)
C.b点溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-=Cl-+ClO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构简式如图所示,有关该物质的说法不正确的是 ( )
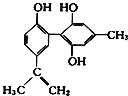
A.该分子中的所有碳原子可能共平面
B.该物质在一定条件下能发生加聚反应
C.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
D.1 mol该物质与足量浓溴水反应时最多消耗Br2为4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器使用方法或实验操作正确的是![]()
A.洗净的锥形瓶和容量瓶可以放进烘箱烘干
B.酸式滴定管装标准溶液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中,正确的是( )
A. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B. 0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后:c(![]() )>c(Cl-)>c(Na+)>c(OH-)>c(H+)
)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. 同浓度的下列溶液中,①(NH4)2SO4、②NH4Cl、③CH3COONH4、④NH3·H2O;c(![]() )由大到小的顺序是:①>②>③>④
)由大到小的顺序是:①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
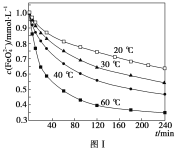
【题目】Ⅰ.高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO42-与水反应的离子方程式:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+__。K2FeO4在处理水的过程中所起的作用是___和____。
4Fe(OH)3+8OH-+__。K2FeO4在处理水的过程中所起的作用是___和____。
(2)将适量K2FeO4配制成c(FeO42-)=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。第(1)题中的反应为FeO42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是___,发生反应的ΔH___0。
Ⅱ.下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
电解质 | 平衡方程式 | 平衡常数K | Ksp |
CH3COOH | CH3COOH | 1.76×10-5 | |
H2CO3 | H2CO3 HCO3- | K1=4.31×10-4 K2=5.61×10-11 | |
C6H5OH | C6H5OH | 1.1×10-10 | |
H3PO4 | H3PO4 H2PO4- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
NH3·H2O | NH3·H2O | 1.76×10-5 | |
BaSO4 | BaSO4 | 1.07×10-10 | |
BaCO3 | BaCO3 | 2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性由强到弱的顺序为___(填编号)。
(2)写出C6H5OH与Na3PO4反应的离子方程式___。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)__c(NH4+)(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol·L-1苯酚溶液中滴加VmL0.01mol·L-1氨水,混合液中粒子浓度关系正确的是__。
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10mL0.01mol·L-1苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2c(NH4
(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com