
科目:高中化学 来源: 题型:
按要求回答下列问题
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_______________________________________。
(2)已知:CH3OH(g)+ O2(g)??CO2(g)+2H2(g)
O2(g)??CO2(g)+2H2(g)
ΔH1=-192.9 kJ·mol-1
H2(g)+ O2(g)??H2O(g)
O2(g)??H2O(g)
ΔH2=-120.9 kJ·mol-1
则甲醇与水蒸气催化重整反应的焓变ΔH3=__________________。
(3)苯乙烯是重要的基础有机原料。工业中用乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH===CH2)的反应方程式为
C6H5—CH2CH3(g)??C6H5—CH===CH2(g)+H2(g) ΔH1
已知:3C2H2(g)??C6H6(g) ΔH2
C6H6(g)+C2H4(g)??C6H5—CH2CH3(g) ΔH3
则反应3C2H2(g)+C2H4(g)??C6H5—CH===CH2(g)+H2(g)的ΔH=____________。
(4)氨的合成是最重要的化工生产之一。
工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)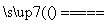 CO(g)+H2(g);
CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)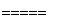 CO(g)+3H2(g)
CO(g)+3H2(g)
已知有关反应的能量变化如下图所示,则方法②中反应的ΔH=____________。
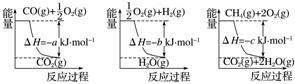
(5)甲醇是一种用途广泛的化工原料。
工业上常用下列两种反应制备甲醇:
①CO(g)+2H2(g)??CH3OH(g)
ΔH1=-90.1 kJ·mol-1
②CO2(g)+3H2(g)??CH3OH(g)+H2O(l) ΔH2
已知:CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH3=-41.1 kJ·mol-1
H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1
则ΔH2=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分被氧化的钠样品10 g,将其投入水中充分反应,将所得溶液稀释成400 mL,若实验测得该钠样品中含有8%的氧元素,则常温下所得溶液的pH为( )
A.14 B.13
C.12 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.在周期表里,元素所在的周期数等于原子核外电子层数
C.最外层电子数为8的都是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知XY2是红棕色气体,Z基态原子的M层与K层电子数相等。Y基态原子的电子排布式是__________________________;Z所在周期中第一电离能最大的主族元素是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分子中既有σ键,又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A.①②③ B.③④⑤⑥
C.①③⑤ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,有浓度均为1 mol·L-1的下列四种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液
④NaOH溶液
(1)这四种溶液pH由大到小的顺序是______,其中由水电离的H+浓度最小的是______。(均填序号)
(2)②中各离子浓度由大到小的顺序是____________,NaHCO3的水解平衡常数Kh=______mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)向③中通入少量氨气,此时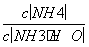 的值______(填“增大”、“减小”或“不变”)。
的值______(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积______④的体积(填“大于”、“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com