
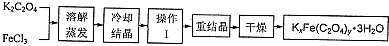
���� ��K2C2O4��FeCl3�Ʊ��ù������ϣ���K2C2O4��FeCl3�ܽ���������ȴ�ᾧ������ϴ�ӵõ��õ����壬Ϊ�����������������Ҫ�����ؽᾧ���ܽ����ϴ�Ӻ���õ���������KxFe��C2O4��y•3H2O��
��1������Ŀ��Ϣ��֪��������KxFe��C2O4��y•zH2O��FeΪ+3�ۣ���һ�ֹ����в��ϣ���֪�ڰ���Ϊ�˷�ֹ�������ֽ⣻
��2������aǰһ������ȴ�ᾧ���ᾧ����뾧����ĸҺ��ϴ�Ӻ��ٽ����ؽᾧ�ᴿ��
��3���ζ������ӻ�ѧ����ʽΪ���������Һ�ζ��������ӷ���������ԭ��Ӧ�����ӷ���ʽ��
��4��������Һ�͵ζ�ʵ����Ҫ����ƿ�͵ζ��ܣ�KMnO4��Һ��ǿ�����ԣ�������ʽ�ζ���ʢ�ţ��ζ��յ������ø��������Һ�ĺ�ɫ�жϷ�Ӧ�ﵽ�յ㣻
��5����MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��֪��n��Fe3+��=5n��MnO4-������2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2��+8H2O��֪n��C2O42-��=$\frac{5}{2}$n��MnO4-�������ݻ�ѧʽ�������y��ֵ�����ݻ��ϼ۴�����Ϊ0����x��ֵ��
��� �⣺��1������Ŀ��Ϣ��֪��������KxFe��C2O4��y•zH2O��FeΪ+3�ۣ���һ�ֹ����в��ϣ���֪�ڰ���Ϊ�˷�ֹ�������ֽ⣬�ñ�ˮ��ȴ�����ܽ�ȣ���������������ľ��壻
�ʴ�Ϊ���ñ�ˮ��ȴ��������������ľ��壬�ڰ����Է�ֹ����ֽ⣻
��2������aǰһ������ȴ�ᾧ���ᾧ����ȻҪ��������ĸҺ���룬������Ҫ���ˣ�������������������ʣ�ϴ�Ӻ��ٽ����ؽᾧ�ᴿ��
�ʴ�Ϊ�����ˡ�ϴ�ӣ�
��3��������ؽ�������������Ϊ�����ӣ��ζ������ӻ�ѧ����ʽΪ���������Һ�ζ��������ӷ���������ԭ��Ӧ�����ӷ���ʽ����ӦΪ��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��
�ʴ�Ϊ��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��
��4������100mL 0.1000mol•L-1KMnO4��Һ����Ҫ�ձ�������������ͷ�ιܡ�100mL����ƿ���ζ�ʵ�黹��Ҫ�ζ��ܣ�KMnO4��Һ��ǿ�����ԣ����Է�����Ƥ�ܣ�������ʽ�ζ���ʢ�ţ���Ӧ�յ������õ������һ�θ��������Һ����Һ�仯Ϊ��ɫ�Ұ���Ӳ��ٱ仯��˵����Ӧ�ﵽ�յ㣻
�ʴ�Ϊ��100mL����ƿ����ʽ�ζ��ܣ��죻
��5����MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��֪��n��Fe3+��=5n��MnO4-��=5��0.004L��0.10mol•L-1=0.002mol����2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2��+8H2O��֪��n��C2O42-��=$\frac{5}{2}$n��MnO4-��=$\frac{5}{2}$��0.024L��0.10mol•L-1=0.006mol������0.002mol��0.006mol=1��y�����y=3�����ݻ��ϼ۴�����Ϊ0��֪��x+3+3����-2��=0�����x=3��������KxFe��C2O4��y•3H2O�Ļ�ѧʽΪ��K3Fe��C2O4��3•3H2O��
�ʴ�Ϊ��3��
���� ���⿼�������Ʊ���������ƣ���ĿŨ���еȣ��漰�����Ʊ�����Һ���ơ�������ԭ��Ӧ�ζ�������֪ʶ�������Ʊ�������ȷ�Ʊ�ԭ��Ϊ���ؼ�������������ѧ���ķ�����������������ѧʵ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ͭ�Ƴ�����ͭ | B�� | ��ˮ������� | ||
| C�� | �Ⱥ˾۱����ԭ�ӱ�ɺ�ԭ�� | D�� | �ɱ����ԭ�Ӿ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��2����Ԫ�ش����ң���������ϼ۴�+1������+7 | |
| B�� | �����ڱ��еĹ���Ԫ����Ѱ�Ұ뵼����� | |
| C�� | Ԫ�����ڱ���Ԫ�ص�������Ԫ�������ڱ��е�λ���й� | |
| D�� | ͬ��Ԫ�ص�ԭ�Ӿ�����ͬ���������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
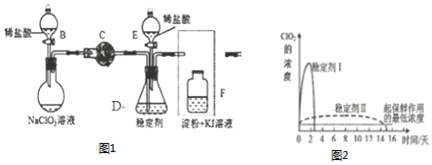
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
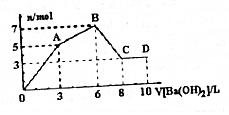 ��Al2��SO4��3��AlCl3�Ļ����Һ����μ���1mol/LBa��OH��2��Һ������������Ba��OH��2��Һ������������ó��������Ĺ�ϵ��ͼ������˵������ȷ���ǣ�������
��Al2��SO4��3��AlCl3�Ļ����Һ����μ���1mol/LBa��OH��2��Һ������������Ba��OH��2��Һ������������ó��������Ĺ�ϵ��ͼ������˵������ȷ���ǣ�������| A�� | ͼ��C����Ԫ�ش��ڵ���ʽ��AlO2- | |
| B�� | ԭ�����Һ��c[Al2��SO4��3]��c��AlCl3��=1��2 | |
| C�� | ��D����Һ��ͨ�����CO2���壬���ս��õ�9mol���� | |
| D�� | OA�η�Ӧ�����ӷ���ʽΪ��2Al3++3SO42-+3Ba2++6OH-�T2Al��OH��3��+3BaSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
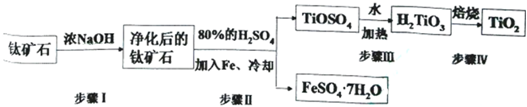
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4+2O2$\stackrel{��ȼ}{��}$CO2+2H2O | B�� | CH2=CH2+H2$��_{��}^{����}$CH3-CH3 | ||
| C�� |  +3H2$��_{��}^{Ni}$ +3H2$��_{��}^{Ni}$ | D�� |  +HNO3��Ũ��$\stackrel{ŨH_{2}SO_{4}}{��}$ +HNO3��Ũ��$\stackrel{ŨH_{2}SO_{4}}{��}$ NO2+H2O NO2+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
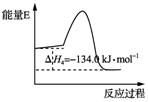 �ҹ����úϳ���ֱ����ϩ�����ش�ͻ�ƣ���ԭ���ǣ�������
�ҹ����úϳ���ֱ����ϩ�����ش�ͻ�ƣ���ԭ���ǣ�������| A�� | ��Ӧ��ʹ�ô�������H3��С | |
| B�� | ��Ӧ��������Ӧ�Ļ�ܴ����淴Ӧ�Ļ�� | |
| C�� | ��H1-��H2��0 | |
| D�� | 3CO��g��+6H2��g��?CH3CH�TCH2��g��+3H2O��g����H=-121.1 kJ•mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com