
常温下,在0.1mol•L﹣1 CH3COOH溶液中,水的离子积是( )
|
| A. | 1×10﹣14 | B. | 1×10﹣13 | C. | 1.32×10﹣14 | D. | 1.32×10﹣15 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
下列反应中,不说明SO2是酸性氧化物的是( )
|
| A. | 2SO2+O2 | B. | SO2+2NaOH═Na2SO3+H2O |
|
| C. | SO2+H2O⇌H2SO3 | D. | SO2+CaO═CaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
|
| A. | 第一电离能:④>③>②>① | B. | 原子半径:④>③>②>① |
|
| C. | 电负性:④>③>②>① | D. | 最高正化合价:④>③=②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A﹣﹣F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
| 化合物 | A | B | C |
| 结构简式 |
|
|
|
| 化合物 | D | E | F |
| 结构简式 |
|
|
|
(1)写出符合下列条件的A的同分异构体的结构简式: .
A.核磁共振氢谱有4组峰
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成红色沉淀
(2)化合物B是制取抗心律失常药物﹣﹣氟卡尼的中间体,下列有关描述不正确的是 (填字母).
A.能与氯化铁溶液显色 B.分子中含有羧基、羟基等官能团
C.能与浓溴水反应 D.能与碳酸钠溶液反应产生二氧化碳
(3)化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为 .
(4)化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去.
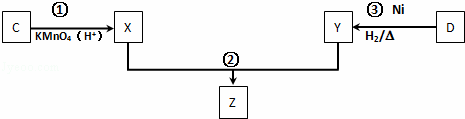
反应③中D与H2按物质的量1:1反应生成Y,则反应②的化学方程式为 .
(5)化合物D与银氨溶液反应的化学方程式(有机物用结构简式表示): .
(6)化合物F是合成克矽平的原料之一,(克矽平是一种治疗矽肺病的药物),其合成路线如下(反应均在一定条件下进行):
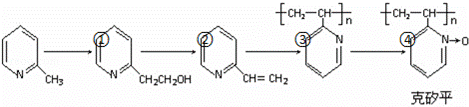
a.反应①是原子利用率100%的反应,则该反应的化学方程式为 ;
b.上述转化关系中没有涉及的反应类型是 (填代号).
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下反应N2(g)+3H2(g)⇌2NH3(g)在2L的密闭容器中进行,测得2min内,N2的物质的量由2mol减小到0.4mol,则2min内N2的反应速率为( )
|
| A. | 0.4mol/L•min | B. | 0.8mol/(L•min) | C. | 1.6mol/L•min | D. | 0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)对于下列反应:2SO2+O2⇌2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 .如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L•min),那么2min时SO2的浓度为 .
(2)下图表示在密闭容器中反应:2SO2+O2⇌2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 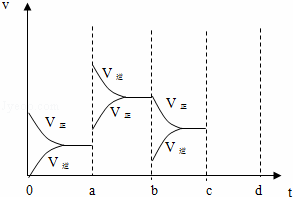
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) 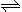 2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.
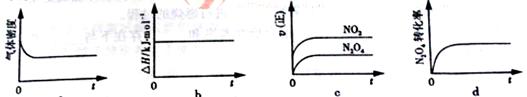
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com