
【题目】Zn在现代工业中对于电池制造上有不可磨灭的地位,明朝末年宋应星所著的《天工开物》一书中就有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)Zn基态原子的电子排布式为___________,4s能级上的成对电子数为___________。
(2)葡萄糖酸锌{[CH2OH( CHOH)4COO]2Zn}是目前市场上流行的补锌剂。葡萄糖酸锌中碳原子杂化形式有___________,C、H两元素的第一电离能的大小关系为___________________。
(3)ZnCl2与NH3形成的配合物[Zn(NH3)4]Cl2中,存在___________(填字母)。
A离子键 B.σ键 C.π键
(4)锌与某非金属元素X形成的化合物晶胞如图所示,其中Zn和X通过共价键结合,该化合物中Zn与X的原子个数之比为___________。
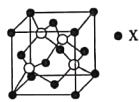
(5)在图示晶胞中若只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___________堆积;设阿伏加德罗常数的数值为NA,该晶胞中Zn的半径为r1nm,X的半径为r2nm,X的相对原子质量为M,则该晶体的密度为___________g·cm-3(用含r1、r2、M、NA的代数式表示)。
【答案】1s22s22p63s23p63d104s2或[Ar] 3d104s2 2 sp2、sp3 C<H AB 1:1 面心立方最密 ![]()
【解析】
(1)Zn原子核外电子数为30,其核外电子排布式为:1s22s22p63s23p63d104s2或[Ar] 3d104s2;
4s能级上只有2个电子且成对,故成对电子数为2;
(2)葡萄糖酸锌里有两种碳原子,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(—COO-里的碳);
第一电离能表示气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,由于H的电子层数少、原子半径最小,原子核对外层电子的引力较强,故第一电离能C<H;
(3) 配合物[Zn(NH3)4]Cl2中[Zn(NH3)4]2+与氯离子形成离子键,Zn2+与NH3之间形成σ键, NH3中氮原子与氢原子之间形成σ键,答案选AB;
(4)根据均摊法计算,晶胞中锌的个数为4个,X的个数为8×![]() +6×
+6×![]() =4,该化合物中Zn与X的原子个数之比为1:1;
=4,该化合物中Zn与X的原子个数之比为1:1;
(5)根据晶胞结构特点可知,X的堆积方式属于金属晶体堆积方式中的面心立方最密堆积;设晶胞得边长是a,则根据晶胞结构可知![]() a=(4r1+4r2)nm,解得a=
a=(4r1+4r2)nm,解得a=![]() nm,则根据
nm,则根据![]() ×NA=4,解得ρ=
×NA=4,解得ρ=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ·mol-1 B. -43.5 kJ·mol-1 C. +43.5 kJ·mol-1 D. +67.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。

请回答下列问题:
(1)操作①应包括下列操作中的____________。(填序号)
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是_________________________________。
(3)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+____(填“是”或“不”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L时即可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH4+) _______c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式_________________________;用简要的文字解释用氢氧化钠调节pH至9~11的原因____________。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3 转化为CaO2过程中,Ca原子的利用率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10L密闭容器中加入5molSO2、4molO2,经10min后反应达平衡时有3molSO2发生了反应.试计算:
(1)用SO2表示该反应的反应速率为______。
(2)平衡时O2的转化率为______。
(3)平衡时O2在反应混合气中的物质的量分数______。
(4)平衡常数K值为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A. 溶质水解反应:HCO3- +H2O![]() H3O++CO32-
H3O++CO32-
B. 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C. 微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D. 微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:________________________。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式为__________________。
④当看到装置C中导管液面上升时应进行的操作是______________________。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_______________________作指示剂,用0.1000mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2S2O32- = 2I- +S4O62-),当看到____________________________现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年政府工作报告提出要持续开展大气污染的治理攻坚。下列不属于大气污染防治措施的是
A.  向酸性土壤中加入熟石灰
向酸性土壤中加入熟石灰
B.  汽车尾气净化减排
汽车尾气净化减排
C.  工业尾气回收处理
工业尾气回收处理
D.  用清洁能源替代化石燃料
用清洁能源替代化石燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SO2的相对分子质量为___,其摩尔质量为____。
(2)标准状况下,0.5 mol任何气体的体积都约为____。
(3)4gH2与标准状况下22.4LSO2相比,所含分子数目较多的是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com