
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
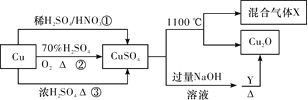
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B. 相对于途径①、③,途径②更好地体现了绿色化学思想
C. 1 mol CuSO4在1100 ℃所得混合气体X中O2为0.75 mol
D. Y可以是葡萄糖
【答案】C
【解析】
由制备流程可以判断①中发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,②中发生2Cu+O2=2CuO、Cu+H2SO4(稀)=CuSO4+H2O;1100℃下Cu元素的化合价降低,则S、O元素的化合价也发生变化,反应为2CuSO4![]() Cu2O+SO2↑+O2↑,Y与氢氧化铜反应生成氧化亚铜,可以知道Y具有还原性,为含-CHO的有机物,以此来解答。
Cu2O+SO2↑+O2↑,Y与氢氧化铜反应生成氧化亚铜,可以知道Y具有还原性,为含-CHO的有机物,以此来解答。
A.葡萄糖含有醛基,能被新制氢氧化铜悬浊液氧化,氢氧化铜被还原为氧化亚铜,所以Y可为葡萄糖,A正确;
B.如途径①用混酸,Cu与混酸反应离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,因此所用混酸中H2SO4与HNO3物质的量之比最好为3∶2,B正确;
C.相对于途径①、③,途径②的优点是制取等质量胆矾需要的硫酸少、途径②无污染性气体产生,所以途径②更好地体现了绿色化学思想,C正确;
D.根据2CuSO4![]() Cu2O+SO2↑+O2↑可知1molCuSO4在1100℃分解,所得混合气体X中O2为0.5mol,D错误。
Cu2O+SO2↑+O2↑可知1molCuSO4在1100℃分解,所得混合气体X中O2为0.5mol,D错误。
答案选D。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
A.H3PO4的酸性比HNO3弱
B.砹(At)的氢化物不稳定
C.硒(Se)化氢比硫化氢稳定
D.氢氧化钡比氢氧化钙的碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,m在常温下为无色无味的液体,n是元素z的单质,通常为黄绿色气体。r溶液为常见的一元强酸,p分子的空间构型为正四面体,s通常是难溶于水的混合物。上述物质的转化关系如图所示。
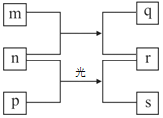
(1)Y形成的简单阴离子结构示意图为_________。
(2)n的电子式为_________。
(3)请列举q的一种用途________。
(4)W、X、Y原子半径的由大到小的顺序为_______(用元素符号表示)。
(5)写出n、p第一步反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为2CH3OH+3O2===2CO2+4H2O。下列说法中不正确的是

A. 左边的电极为电池的负极,a处通入的是甲醇
B. 每消耗3.2 g氧气转移的电子为0.4 mol
C. 电池负极的反应式为CH3OH+H2O6e===CO2+6H+
D. 电池的正极反应式为O2+2H2O+4e===4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是: ( )
A.CuCl2 = Cu + Cl2 ↑B.HI = H++I-
C.H2SO4 = 2H++SO4-2D.NaHCO3 = Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.摩尔是七个基本物理量之一
B.1 mol任何物质都含有6.02×1023个分子
C.标准状况下,1 mol任何物质体积均为22.4 L
D.摩尔质量在数值上等于该物质的相对分子质量或相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(33As)在周期表中与氮同主族,砷及其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷化氢的电子式为_________。
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒。As2O3是一种两性氧化物,写出As2O3溶于浓盐酸的化学方程式_____________________。
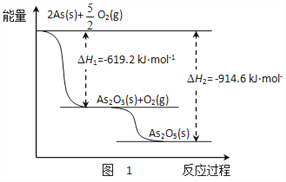
(3)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式________________________________________。
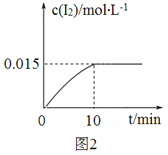
(4)砷酸钠(Na3AsO4)具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①0~10 min内,I的反应速率v(I)=______________。
②在该条件下,上述反应的平衡常数K=__________。
③升高温度,溶液中AsO43-的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(5)己知砷酸(H3ASO4)是三元酸,有较强的氧化性。
①常温下砷酸的Ka1=6×10-3、Ka2=1×10-7,则 NaH2AsO4溶液中c(HAsO42-)___c(H3AsO4)(填“>”、“<”或“=”)。
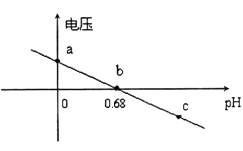
②某实验小组依据反应AsO43-+2H++2I-AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得输出电压与pH的关系如图。则a点时,盐桥中K+____移动(填“向左”、“向右”或“不”),c点时,负极的电极反应为____________________。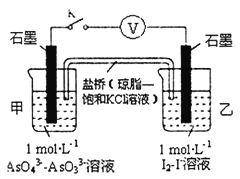
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com