
[化学-选修化学与技术](15分)
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
|
pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
|
温度/℃ |
10 |
30 |
40 |
50 |
60 |
|
CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
|
MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
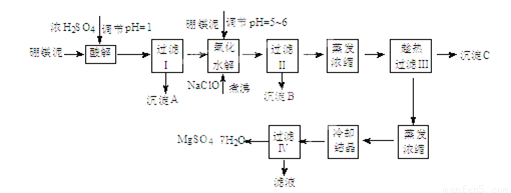
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的 Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的 是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤III需趁热过滤的理由是
(1)Mn2++ClO-+H2O=MnO2↓+2H++Cl-(2分)
促进Al3+、Fe3+水解及Mn2+氧化成MnO2(2分)
(2)Fe(OH)3(2分) Al(OH)3(2分)
(3)取过滤II后的滤液1~2 mL于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+(3分)
(4)CaSO4·2H2O或CaSO4(2分) 以防MgSO4在温度低时结晶析出(2分)。
【解析】
试题分析:(1)过滤I的滤液中加入NaClO溶液将溶液中的Mn2+氧化成MnO2,ClO-还原为Cl-,氧化还原类型的离子反应书写要遵循电子守恒、原子守恒和电荷守恒,答案为Mn2++ClO-+H2O=MnO2↓+2H++Cl-;过滤I的滤液中还含有Al3+、Fe3+等离子,调节溶液的pH=5~6,目的为将Al3+、Fe3+转化Fe(OH)3、Al(OH)3沉淀,加热煮沸的目的促进Al3+、Fe3+水解及Mn2+氧化成MnO2;
(2)由(1)知沉淀中还有Fe(OH)3、Al(OH)3
(3)考查Fe3+的检验。注意文字叙述。答案为取过滤II后的滤液1~2 mL于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+
(4)由表二中的溶解度数据可知:温度较高时硫酸钙的溶解度较小,而硫酸镁的溶解度较大,趁热过滤时,易于分离混合物,此时过滤得到的沉淀为CaSO4•2H2O或CaSO4,如不趁热过滤,冷却后硫酸镁的溶解度减小,会生成硫酸镁晶体
考点:以工艺流程为载体考查离子方程式的书写、离子检验以及分析数据提取信息的能力。


科目:高中化学 来源: 题型:
 (2011?湖南二模)[化学一选修化学与技术]
(2011?湖南二模)[化学一选修化学与技术]
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com