
| A、加热可增强纯碱溶液的去污力:CO32-+2H2O═H2CO3+2OH-_Q(Q>0) |
| B、向Ca(HCO3)2(aq)中加入少量澄清石灰水出现白色沉淀:Ca2++OH-+HCO3-→CaCO3↓+H2O |
| C、Fe3O4溶于稀HNO3:Fe3O4+8H+→Fe2++2Fe3++4H2O |
| D、稀硝酸可洗去试管内壁的银镜:Ag+2H++NO3-→Ag++NO2↑+H2O |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
| A、①②③④ | B、全部 |
| C、①②⑤ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物的稳定性:D>C |
| B、原子半径:A>B>C>D |
| C、单质的还原性:B>A |
| D、原子序数:b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属元素呈现的最高正化合价数值上不超过该元素原子的最外层电子数 |
| B、非金属元素呈现的最低负化合价,其绝对值等于该元素原子的最外层电子数 |
| C、最外层有2个电子的原子都是金属原子 |
| D、最外层有5个电子的原子都是非金属原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、共用电子对偏移程度:H-Cl>H-Br |
| B、酸性:HClO4>HBrO4 |
| C、热稳定性:HCl>HBr |
| D、酸性:HCl<HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| A2B溶液的体积(mL) | 60 | 60 | 60 | 60 | 60 | 60 | 60 |
| CD2溶液的体积(mL) | 0 | 20 | 40 | 60 | 70 | 80 | 120 |
| 沉淀质量(g) | 0 | 0.464 | 1.395 | 1.404 | 1.397 |
查看答案和解析>>
科目:高中化学 来源: 题型:
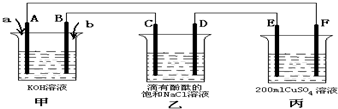
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com