
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.根据探究实验得出结论:
(1)废液中含有的金属离子是 。
(2)求10mL废液中氯离子的物质的量浓度?
(3)求10mL废液中铜离子的物质的量是 ?
(1) (2分)
(2分)
(2)6.02×1023或NA;1mol (每空2分) (3)160g(4分)
解析试题分析:(1)依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;锰元素化合价从+7价降低到+2价,得到5个电子;氯元素化合价从-1价升高为0价,失去1个电子,所以双线桥表示为: ;(2)依据化学方程式和元素化合价变化判断电子转移,计算被氧化的物质的量;2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。若生成标准状况下11.2L 氯气,物质的量=11.2L÷22.4L/mol=0.5mol;生成5molCl2,转移电子为10mol,所以生成0.5mol氯气转移转移电子为1mol,其个数是6.02×1023或NA;16molHCl反应,其中被氧化的HCl为10mol;生成氯气物质的量为5mol,所以0.5mol氯气生成,被氧化的HCl为1mol。(3)参加反应的氯化氢的物质的量是1.6mol其质量=1.6mol×363.5g/mol,所以需消耗36.5%的浓盐酸的质量为1.6mol×363.5g/mol÷36.5%=160g。
;(2)依据化学方程式和元素化合价变化判断电子转移,计算被氧化的物质的量;2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。若生成标准状况下11.2L 氯气,物质的量=11.2L÷22.4L/mol=0.5mol;生成5molCl2,转移电子为10mol,所以生成0.5mol氯气转移转移电子为1mol,其个数是6.02×1023或NA;16molHCl反应,其中被氧化的HCl为10mol;生成氯气物质的量为5mol,所以0.5mol氯气生成,被氧化的HCl为1mol。(3)参加反应的氯化氢的物质的量是1.6mol其质量=1.6mol×363.5g/mol,所以需消耗36.5%的浓盐酸的质量为1.6mol×363.5g/mol÷36.5%=160g。
考点:考查氧化还原反应方程式配平、计算以及质量百分比浓度的计算。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:填空题
绿矾(FeSO4?7H2O)是中学阶段常用的一种还原剂。
(1)久置的绿矾溶液容易被空气氧化变质,简述检验绿矾溶液已经变质的操作和现象:取少量待测液于试管中, 。
(2)绿矾溶液浓度的标定测定溶液中Fe2+物质的量浓度的方法是:
a.量取25.00mL待测溶液于锥形瓶中;
b.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点;
c.重复操作2次,消耗KMnO4溶液体积的体积分别为20.02mL、24.98mL、19.98mL。
(已知滴定时发生反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①判断此滴定实验达到终点的方法是 。
②计算上述滤液中Fe2+物质的量浓度 (保留四位有效数字)。
(3)探究保存绿矾溶液的有效措施
【反应原理】Fe2+在空气中易氧化变质,完成并配平下列离子方程式:
Fe2+ + O2 + = Fe(OH)3↓+ Fe3+
【操作与现象】取4支试管,如图进行实验,请在相应位置上写出试管①的现象和④的添加试剂。
【分析与结论】设计试管①的作用是 ;为了有效保存FeSO4溶液,你认为最佳方案为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为: 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
除去Al3+的离子方程式是 。
(3)为验证炉渣中含有FeO,先将炉渣用稀酸溶解,再在酸性条件下加入适当的氧化剂。(提供的试剂:稀盐酸、稀硫酸、KSCN溶液、酸性KMnO4溶液、NaOH溶液、碘水)
所选试剂为 、 ,证明炉渣中含有FeO的实验现象为 。
(4)配平上述反应的离子方程式(氧化性物质依据你的选择填入[ ])
Fe2++ H++ [ ] → Fe3++ [ ]+ H2O
(5)如果证明炉渣中是否含有FeO,将炉渣溶于稀硝酸,每含有1molFeO,可产生气体的体积是 L(标准状况,假设硝酸的还原产物只有NO)。
(6)Fe2O3可以作为染料,也可进一步制得净水剂Fe2(SO4)3, Fe2(SO4)3的净水原理是 (用相应的方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在下列反应中:
| A.2F2+2H2O=4HF+O2↑; | B.2Na+2H2O=2NaOH +H2↑; | C.CaO+H2O=Ca(OH)2; | D.2H2O 2H2↑+O2↑。其中(填序号): 2H2↑+O2↑。其中(填序号): |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)如图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体成,则生成该气体的电极反应式为 。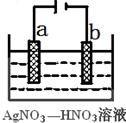
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
| A.Na2O2 + 2HCl =" 2NaCl" + H2O2 |
| B.Ag2O + H2O2 =" 2Ag" + O2↑ + H2O |
| C.2H2O2 = 2H2O + O2↑ |
| D.3H2O2 + Cr2(SO4)3 + 10KOH = 2K2CrO4 + 3K2SO4 + 8H2O |

| 实验内容 | 试剂 | 实验现象 |
| 验证氧化性 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水(H2O)在很多化学反应中有极其重要的作用。请研究下列水参与的氧化还原反应。
①NaH+H2O=NaOH+H2↑ ②2Na2O2+2H2O=4NaOH+O2↑
③2Na+2H2O="2NaOH" +H2↑ ④3NO2+H2O=2HNO3+NO↑
⑤2H2O 2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2
2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2
(1)水只作氧化剂的是 ;水只作还原剂的是 ;水既作氧化剂,又作还原剂的是 ;水既不作氧化剂,又不是还原剂的是 。
(2)水作氧化剂时,被还原的元素是 ,水作还原剂时,被氧化的元素是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室中所用少量氯气是用下列方法制取的:
4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
(1)该反应既是离子反应也是氧化还原反应。该反应的还原剂是 (用化学式表示)。
氯气有毒会污染空气,实验室常用氢氧化钠吸收该实验的尾气,写出用氢氧化钠溶液吸收氯气的离子方程式 。
(2)若有17.4gMnO2与足量的浓盐酸充分反应后, 所得溶液的体积为500 mL,求:
①转移电子数为______ _;
②被氧化的HCl的物质的量_______ mol;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)请完成该反应的离子方程式:
C + MnO4- + H+ — CO2↑+ Mn2+ + H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
 pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com