
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
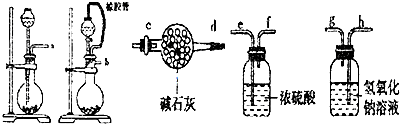
分析 (1)根据反应装置--干燥装置--吸收装置-尾气处理装置排序;空气中的水和二氧化碳影响实验结果;
(2)盐酸和硝酸都具有挥发性;
(3)酸式滴定管只能量取酸性溶液,碱式滴定管只能量取碱性溶液,根据溶液的酸碱性确定滴定管;根据滴定终点确定指示剂;滴定终点时溶液从无色变为浅红色,30s内不褪色;
根据氢氧化钠和硫酸铵的关系式计算硫酸铵的量,最后再计算N元素的含量;
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,导致硫酸铵的测定结果偏小;
(5)碳酸氢钠和氢氧根离子反应生成碳酸根离子和水.
解答 解:(1)根据反应装置--干燥装置--吸收装置-尾气处理装置排序,所以其排列顺序是:b-e-f-h-g-c,为防止影响实验结果,需要吸收二氧化碳和水蒸气,
故答案为:b-e-f-h-g-c;防止空气中水和二氧化碳进入装置影响实验结果;
(2)制取二氧化碳时需要碳酸盐和酸反应,稀盐酸、浓硝酸都具有挥发性,影响实验结果,氢氧化钠和盐不能生成二氧化碳,
故答案为:B;
(3)因为滴定终点的pH约为8.8,酚酞的变色范围是8-10,所以选取酚酞作指示剂;
2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4+6H2O、2NaOH+H2SO4=Na2SO4+2H2O,所以硫酸铵和NaOH的关系式为:(NH4)2SO4~2NaOH,NaOH溶液的平均体积=$\frac{(16.21-1.20)+(18.90-3.00)+(19.49-4.50)}{3}$mL=15.3mL,根据(NH4)2SO4~2NaOH得m[(NH4)2SO4]=$\frac{0.0153L×0.08mol/L}{2}$=0.0808g,0.6g硫酸铵中硫酸铵的质量=0.0808g×5=0.404g,
氮元素的质量分数=$\frac{0.404g×\frac{28}{132}}{0.6g}$×100%=14%,
故答案为:酚酞;14%;
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,导致NaOH溶液的量偏小,根据(NH4)2SO4---2NaOH得,导致测定N含量偏小,
故答案为:偏小;
(5)因为根据反应原理2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4可知,用甲醛法制的是碳酸,而碳酸不稳定,不适合中和滴定,
故答案为:否;用甲醛法制的碳酸不稳定,不适合中和滴定.
点评 本题考查了探究物质组成与测定含量的方法,题目难度中等,明确实验原理是解本题关键,根据物质间的反应结合实验操作进行解答,此种类型的题阅读量较大,同时考查书写获取信息、加工信息的能力,注意(4)中酸碱指示剂的选取方法,注意取用的溶液为配制溶液的五分之一,不是全部溶液,为易错点.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | 锂所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3 | |
| D. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 世博会期间,处理废水时加入明矾可作为混凝剂以吸附水中的悬浮物杂质且有杀菌消毒的作用 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染 | |
| C. | 世博会中国馆--“东方之冠”使用了大量钢筋混凝土,混凝土是混合物 | |
| D. | 世博停车场安装光电设施,可将阳光转化为电能以供应照明 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
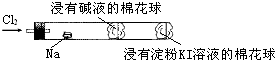
| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| D. | 管右端棉球外颜色变化可判断氯气是否被碱液完全吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的名称和一氯代物的种数是( )
的名称和一氯代物的种数是( )| A. | 2,4,5-三甲基-4-乙基己烷,7种 | B. | 2,4-二甲基-4-异丙基己烷,8种 | ||
| C. | 2,4-二甲基-3-异丙基己烷,7种 | D. | 2,3,5-三甲基-3-乙基己烷,8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石和稀盐酸反应:2H++CO32-═CO2↑+H2O | |
| B. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 氧化铝和氢氧化钠溶液反应:Al2O3+OH-═AlO2-+H2O | |
| D. | 稀硝酸溶液中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似 | |
| C. | 燃料电池的燃料都在负极发生氧化反应 | |
| D. | Fe3O4俗称铁红,常做红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓醋酸 | 石灰石 | Na2SiO3溶液 | 酸性:醋酸>碳酸>硅酸 | |
| B | 浓盐酸 | KMnO4 | KBr溶液 | 氧化性:KMnO4>Cl2>Br2 | |
| C | 稀硫酸 | FeS | SO2水溶液 | BaS可还原SO2 | |
| D | 盐浓酸 | 浓硫酸 | BaSO3悬浊液 | BaSO3可溶于盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com