
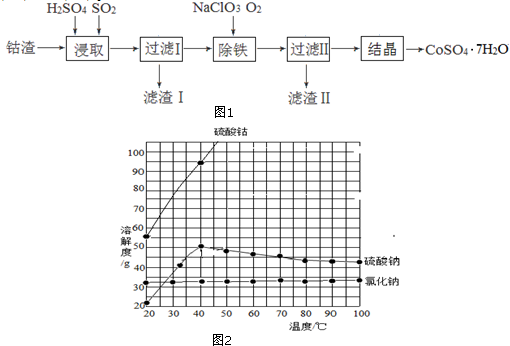
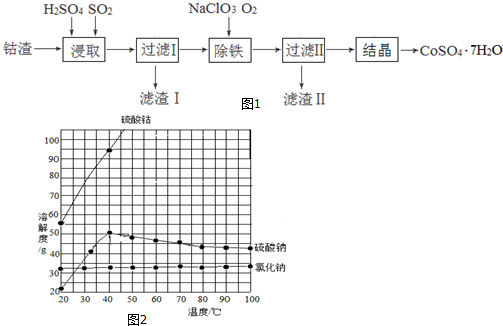
分析 利用钴渣[含Co(OH)3、Fe(OH)3]制备硫酸钴晶体( CoSO4•7H2O)的工艺流程:均速向钴渣和稀硫酸的化合物中通入SO2,发生2Co(OH)3+2H++SO2=2Co2++SO42-+4H2O,使Co(OH)3、Fe(OH)3被充分浸取,同时通入二氧化硫会使溶液中液体不停地运动,起到搅拌的作用,从而加快反应速率,过滤得到滤渣1为铜,加入氯酸钠、通入氧气,除铁,铁元素以氢氧化铁的形式沉淀,滤渣Ⅱ的成分为Fe(OH)3,过滤Ⅱ得到的滤液经过蒸发浓缩、趁热过滤冷却到40℃结晶操作得到CoSO4•7H2O粗产品.
(1)二氧化硫具有还原性,+3价的钴具有氧化性,浸取Co(OH)3的反应为+4价硫和+3价的钴间的氧化还原反应,根据离子反应方程式书写方法书写,二氧化硫气体通入溶液中,能起搅拌作用,能加快浸取速率;
(2)Co2+具有还原性,除铁过程中,若选用氧化性更强的NaClO除铁,可造成Co2+被氧化;
(3)铁元素以氢氧化铁的形式沉淀,形成氢氧化铁沉淀需消耗氢氧根离子,溶液的PH降低;
(4)从溶液中得到固体应蒸发浓缩、结晶,然后过滤,溶液含有溶质有硫酸钴、硫酸钠、氯化钠,冷却到40℃结晶目的防止析出硫酸钠晶体杂质.
解答 解:(1)二氧化硫具有还原性,Co3+具有氧化性,均速向钴渣和稀硫酸的化合物中通入SO2,使Co(OH)3、Fe(OH)3被充分浸取,实际是利用二氧化硫的还原性,使Co3+还原成Co2+,使Fe3+还原成Fe2+,所以浸取Co(OH)3的离子方程式为:2Co(OH)3+2H++SO2=2Co2++SO42-+4H2O,通入二氧化硫会使溶液中液体不停地运动,起到搅拌的作用,从而加快反应速率,
故答案为:2Co(OH)3+2H++SO2=2Co2++SO42-+4H2O;搅拌,加快浸取速率;
(2)次氯酸钠的氧化性过强,除铁过程中,若选用氧化性更强的NaClO除铁,可能会使Co2+被氧化成Co3+,
故答案为:氧化性过强,会Co2+使被氧化;
(3)除铁是把铁变成了氢氧化铁,过滤时,得到的滤渣为氢氧化铁,生成的氢氧化铁沉淀时要消耗溶液中的氢氧根离子,溶液的PH降低,
故答案为:Fe(OH)3;降低;
(4)从溶液中得到固体应首先蒸发浓缩、结晶,然后过滤,该溶液含有溶质有硫酸钴、硫酸钠、氯化钠,由溶解度曲线可知,氯化钠、硫酸钠溶解度在高温时,随温度变化小,而硫酸钴的变化大,在低于40度时,硫酸钠、硫酸钴的溶解度随温度变化都较大,在加热时浓缩时,高温下,氯化钠、硫酸钠溶解度小,它们会首先析出,硫酸钴的溶解度大,不能析出,趁热过滤可除去一部分硫酸钠晶体,氯化钠,在冷却结晶,此时的主要是硫酸钴晶体,当温度低于40度时,硫酸钠晶体也析出,
故答案为:蒸发浓缩、趁热过滤;防止析出硫酸钠晶体.
点评 本题考查硫酸钴晶体的制备,掌握氧化还原、物质的分离与提纯相关知识是解答关键,题目难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应速率主要取决于反应②的快慢 | B. | 反应速率v(NO)=v(NOBr)=2v(Br2) | ||
| C. | NOBr2是该反应的催化剂 | D. | 该反应的焓变等于akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
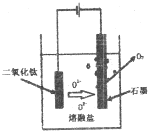
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
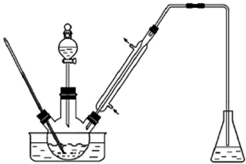 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
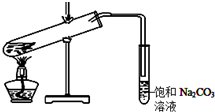 某学生做乙酸乙酯的制备实验装置如图所示.
某学生做乙酸乙酯的制备实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)=H2(g)+$\frac{1}{2}$ O2(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)=2H2O (l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)=H2O (g)△H=-242 kJ | D. | 2H2(g)+O2(g)=2H2O (g)△H=+484 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com