
分析 能导电的物质含有自由移动的电子或阴阳离子;
电解质是指:在水溶液中或熔融状态下能够导电的化合物;
非电解质是指:在熔融状态和水溶液中都不能导电的化合物,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子;
单质,混合物既不是电解质也不是非电解质,根据定义即可解答.
解答 解:a.②水银含有自由移动的电子,所以能导电,④稀硫酸、⑥氨水、⑨熔融氯化钠中含有自由移动的阴、阳离子,所以能导电;
故答案为:②④⑥⑨;
b.①氢氧化钠固体、③氯化氢气体、⑦碳酸钠粉末、⑨熔融氯化钠、⑩胆矾在水溶液里或熔融状态下能电离出阴阳离子,所以是电解质;
故答案为:①③⑦⑨⑩;
c.⑤CO2在水溶液中与水反应生成碳酸,碳酸电离出自由移动的氢离子和碳酸氢根离子,溶液导电,CO2自身不能电离,CO2是非电解质;⑧是化合物,但其水溶液只存在蔗糖分子,不导电,属于非电解质;
故答案为:⑤⑧.
点评 本题考查了电解质和非电解质的判断及能导电的物质,注意能导电的物质不一定是电解质,电解质不一定导电,为易错点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol N2(g)和 3mol H2(g)具有的能量之和低于 2 mol NH3(g)具有的能量 | |
| B. | 将 1mol N2(g)和 3mol H2(g)置于一密闭容器中充分反应后放出 Q kJ 的热量 | |
| C. | 升高温度,平衡向逆反应方向移动,上述热化学方程式中的 Q 值减小 | |
| D. | 将一定量 N2、H2置于某密闭容器中充分反应放热 Q kJ,则此过程中有 3mol H2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将4 g NaOH溶解在1L蒸馏水中 | |
| B. | 用托盘天平称量5.85g NaCl固体溶于蒸馏水,配成1000mL溶液 | |
| C. | 常温常压下,将11.2L HCl气体溶于蒸馏水,配成500mL溶液 | |
| D. | 取50 mL 0.5mol/L 的KNO3溶液用蒸馏水稀释,配成250mL 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L溶液中含阴、阳离子总数是0.6 NA | |
| B. | 500 mL溶液中Ba2+的浓度是0.2 mol•L-1 | |
| C. | 500 mL溶液中NO-3的浓度是0.4 mol•L-1 | |
| D. | 1 L溶液中含有0.2 NA个NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 41.3% | B. | 8.7% | C. | 1.74% | D. | 2.14% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
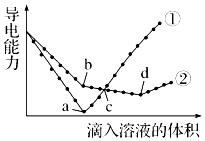 常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | ①代表滴加H2SO4溶液的变化曲线 | B. | b点,水电离产生的c(H+)<10-7mol/L | ||
| C. | c点,两溶液中含有相同量的 OH- | D. | a、d两点对应的溶液均显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定 序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com