
分析 ①根据配制一定物质的量浓度的步骤选择使用的仪器;②配制450mL 0.25mol•L-1NaOH溶液,实验室没有450mL容量瓶,需要选用500mL容量瓶进行配制;
②依据m=CVM计算需要溶质的质量;依据天平使用方法分析将物码放反对溶质的质量的影响;
③根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:①配制450mL 0.25mol•L-1NaOH溶液,实验室没有450mL容量瓶,需要选用500mL容量瓶进行配制,
配制500mL0.25mol•L-1 NaOH溶液,需要的步骤有:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,需要使用的仪器有:托盘天平、药匙、小烧杯、玻璃棒、500mL容量瓶、胶头滴管;
故答案为:500ml容量瓶、小烧杯;
②配制450mL 0.25mol•L-1NaOH溶液,需要配制500mL0.25mol•L-1 NaOH溶液,需要氢氧化钠的质量为:40g/mol×0.25mol/L×0.5L=5.0g;不需要使用游码,结果不变,
故答案为:5.0g;不变;
③定容时观察液面仰视,造成体积偏大,浓度偏小,
故答案为:偏小.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶、天平使用的方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
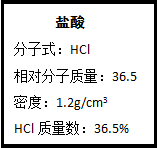 图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑥ | C. | ②③⑤ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90% | B. | 80% | C. | 50% | D. | 40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:3 | B. | 3:1:2 | C. | 3:2:1 | D. | 9:3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向AgCl悬浊液中滴加NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L的H2SO4溶液 | B. | 0.2mol/L醋酸 | ||
| C. | 0.2mol/L的HCl溶液 | D. | 0.2mol/L的NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com