
【题目】X、Y、Z、Q、R均为短周期元素(原子序数Y<X<R<Q<Z)。25℃时,其最高价氧化物的水化物溶液(浓度均为0.001mol/L)的pH和原子半径的关系如图所示。下列说法中正确的是( )
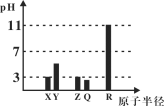
A.X和R的简单离子半径:X < R
B.Z、Q的气态氢化物的稳定性:Z > Q
C.Z的最高价氧化物对应水化物的化学式为HZO3
D.上述五种元素中有两种元素是金属元素
【答案】B
【解析】
这几种元素都是短周期元素,XYZQ元素最高价氧化物的水合物溶液pH都小于7,说明其最高价氧化物的水合物都是酸,则这几种元素都是非金属元素,0.001mol/L的X、Z的最高价氧化物的水合物pH=3,为一元强酸,X的原子半径最小,该强酸是硝酸,则X为N元素,Z为S元素;Y的原子序数小于X,且为弱酸,应该是C元素;Z的原子半径大于X且为一元强酸,为Cl元素;R的氧化物的水合物呈碱性,且0.001mol/L的R最高价氧化物的水合物pH=11,则为一元强碱,且原子半径最大,则为Na元素;通过以上分析知,XYZQR分别是N、C、Cl、S、Na元素。
A.X和R分别是N、Na元素,氮离子和钠离子电子层结构相同,电子层结构相同的离子,离子半径随着原子序数增大而减小,则离子半径:X>R,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S,则氢化物的稳定性:Z>Q,故B正确;
C.D为Cl元素,其最高价氧化物的水合物是HClO4,故C错误;
D.这几种元素中只有Na是金属元素,故D错误;
故选:B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关有机物物理性质描述错误的是
A.甲醛是一种无色,有强烈刺激性气味的气体,易溶于水,![]() 的甲醛水溶液叫做福尔马林
的甲醛水溶液叫做福尔马林
B.苯酚又名石炭酸、常温下为无色液体,当温度高于![]() 时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
C.甲醇是无色有酒精气味易挥发的液体,有毒,误饮![]() 毫升能双目失明,大量饮用会导致死亡
毫升能双目失明,大量饮用会导致死亡
D.甲酸,无色而有刺激气味的液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,是人体的“第七营养素”。木质素是一种非糖类膳食纤维。其单体之一——芥子醇结构简式如下图所示,下列有关芥子醇的说法正确的是( )

A. 芥子醇分子中有两种含氧官能团
B. 芥子醇分子中所有碳原子不可能在同一平面上
C. 1 mol芥子醇与足量浓溴水反应,最多消耗3 mol Br2
D. 芥子醇能发生的反应类型有氧化、取代、加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是高熔点金属,工业上用主要成分为FeWO4和MnWO4的黑钨铁矿与纯碱共熔冶炼钨的流程如下,下列说法不正确的是( )

A.将黑钨铁矿粉碎的目的是增大反应的速率
B.共熔过程中空气的作用是氧化Fe(II)和Mn(II)
C.操作II是过滤、洗涤、干燥,H2WO4难溶于水且不稳定
D.在高温下WO3被氧化成W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验溶液中的离子或物质,所用方法正确的是( )
A.加入硝酸银溶液,有白色沉淀生成,证明一定有Cl-存在
B.加入BaCl2溶液和稀硝酸,有白色沉淀生成,证明一定有![]()
C.加入KSCN溶液,有红色物质生成,证明一定含有Fe2+
D.加入淀粉-KI溶液,变蓝色,说明可能有Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:
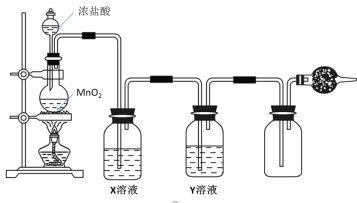
(1)写出实验室制取氯气的离子方程式_____________,NA表示阿伏加德罗常数的值,若有3mol的HCl被氧化,则转移的电子总数为______;将足量的MnO2投入含4molHCl的浓盐酸中,充分加热,可生成的Cl2________(填“>”“=”或“<”)1mol。
(2)现有3种试剂可供选择:A.饱和食盐水 B.浓硫酸 C.NaOH溶液,则Y溶液应选用________(填字母),X溶液的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是
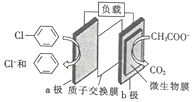
A. b极为正极,发生还原反应
B. 一段时间后b极区电解液的pH减小
C. H+由a极穿过质子交换膜到达b极
D. a极的电极反应式为![]() -e-=Cl-+
-e-=Cl-+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1 ℃时,测得各物质平衡时物质的量如下表:
活性炭(mol) | NO(mol) | A(mol) | B(mol) | |
初始 | 2.030 | 0.100 | 0 | 0 |
平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
在T1 ℃时,达到平衡共耗时2分钟,则NO的平均反应速率为________ mol·L-1·min-1;当活性炭消耗0.015 mol时,反应的时间________(填“大于”、“小于”或“等于”)1分钟。
(2)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:

①该反应在0~8min时,CO2的转化率是________。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。a、b、c、d四点中逆反应速率大小关系为_________,M、b、N三点中平衡常数K的大小关系是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com