
【题目】短周期金属元素甲~戊在周期表中的相对位置如下表所示,下面判断不正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A. 金属性:甲<丙
B. 最高价氧化物对应的水化物的碱性:丙>丁>戊
C. 原子半径:丁>丙>甲
D. 最外层电子数:乙>甲
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮族元素单质及其化合物有着广泛应用。
(1)在1. 0 L密闭容器中放入0. 10mol PCl5(g),一定温度进行如下反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH1,反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
PCl3(g)+Cl2(g) ΔH1,反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
时间t/s 温度 | 0 | t1 | t2 | t3 | t4 | t5 |
T1 | 5. 00 | 7. 31 | 8. 00 | 8. 50 | 9. 00 | 9. 00 |
T2 | 6. 00 | -- | -- | -- | 11. 00 | 11. 00 |
回答下列问题:
①PCl3的电子式为_______。
②T1温度下,反应平衡常数K=______。
③T1___T2(填“>”、“<”或“=”,下同),PCl5的平衡转化率α1(T1) __α2(T2)。
(2)NO在一定条件下发生如下分解:3NO(g)![]() N2O(g)+NO2(g)
N2O(g)+NO2(g)
在温度和容积不变的条件下,能说明该反应已达到平衡状态的是________(填字母序号)。
a. n(N2O)=n(NO2) b. 容器内压强保持不变 c. v正(N2O)=v逆(NO2) d. 气体颜色保持不变
(3)次磷酸钴[Co(H2PO2)2]广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如下图。
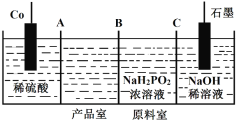
①Co的电极反应式为_______。
②A、B、C为离子交换膜,其中B为____离子交换膜(填“阳”或“阴”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁条,再滴入5 mL的稀盐酸。
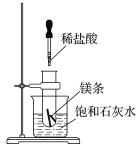
回答下列问题:
(1)实验中观察到的现象是____________________________________________。
(2)产生上述现象的原因是_________________________________________________。
(3)写出有关反应的离子方程式_________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用酸性KMnO4和H2C2O4反应来探究“外界条件对化学反应速率的影响”。 实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
(1)已知草酸H2C2O4是一种二元弱酸,写出草酸的电离方程式______________、_____________。
某同学设计了如下实验:
实验编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
b | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(2)探究浓度对化学反应速率影响的组合实验编号是__________,可探究温度对化学反应速率影响的实验编号是__________。
(3)实验a测得混合后溶液褪色的时间为40s,忽略混合前后体积的微小变化,则这段时间内的平均反应速率v(KMnO4)=______ mol·L-1·min-1。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快,褪色速率后来加快的原因可能是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活生产中应用广泛,下列说法错误的是( )
A. 除夕夜色彩斑斓的烟火利用了金属的焰色反应
B. 减少汽车尾气的排放是控制酸雨危害的途径之一
C. 纯碱是钠的重要化合物之一,可用于治疗胃酸过多
D. 乙烯可以用来衡量一个国家的石油化工发展水平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在化工生产、污水处理等领域应用广泛。
Ⅰ.羰基硫(O=C=S)广泛存在于以煤为原料制备的各种化工原料气中,能引起催化剂中毒、大气污染等。羰基硫的水解和氢解是两种常用的脱硫方法,其反应式分别为:
a.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-35 kJ/mol
H2S(g)+CO2(g) △H1=-35 kJ/mol
b.氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H2
H2S(g)+CO(g) △H2
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3=-42kJ/mol
H2(g)+CO2(g) △H3=-42kJ/mol
(1)完成上述氢解反应的热化学方程式:______。
(2)一定条件下,密闭容器中发生反应a,其中COS(g)的平衡转化率(α)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是______(填字母)。
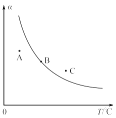
(3)反应b的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(K正)的是______(填“A”或“B”)。
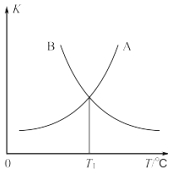
(4)T1℃时,向容积为10L的恒容密闭容器中充入2molCOS(g)和2molH2(g),发生反应b,则:COS的平衡转化率为______。
Ⅱ.矿石冶炼与含硫化合物有关。
(5)将冰铜矿(主要为Cu2S和FeS相熔合而成)加熔剂(石英砂)在1200℃左右吹入空气进行吹炼:Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程中发生反应的化学方程式分别是:___________;___________。
(6)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性。
①吸收Cl2后的溶液中一定存在的阴离子有OH-、______。
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液。此实验不能证明溶液中含有SO32-,理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
由上述方程式可知:CH3OH的燃烧热________(填“大于”“等于”或“小于”)192.9 kJ/mol。已知水的气化热为44 kJ/mol。则表示氢气燃烧热的热化学方程式为__________________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式____________________。
(3)已知:①Fe(s)+1/2O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
②2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
Al和FeO发生铝热反应的热化学方程式是___________________________________。
某同学认为,铝热反应可用于工业炼铁,你的判断是________(填“能”或“不能”),你的理由____________________________________。
(4)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25 ℃、101 KPa下:
①H2(g)+1/2O2(g)===H2O(g) ΔH1=-242 kJ/mol
②CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g)
ΔH2=-676 kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. 氯化氢的电子式:![]() B. 镁的原子结构示意图:
B. 镁的原子结构示意图:![]()
C. 乙烯的结构简式:CH2CH2 D. 碳酸钠的电离方程式:Na2CO3=Na++CO32一
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com