
| A. | pH=0的溶液中:K+、ClO-、CH3CHO、SO42- | |
| B. | c(H+)=10-12mol•L-1的溶液中:Na+、NH4+、Cl-、Br- | |
| C. | 加人KSCN显血红色的溶液中:Br-、NO3-、SO42-、Mg2+ | |
| D. | 在加入Al能放出大量H2的溶液中:NH4+、SO42-、C1-、HCO3- |
分析 A.pH=0的溶液为酸性溶液,溶液中存在大量氢离子,次氯酸根离子与氢离子反应生成次氯酸,次氯酸能够氧化乙醛;
B.c(H+)=10-12mol•L-1的溶液为碱性溶液,溶液中存在大量氢氧根离子,铵根离子与氢氧根离子反应;
C.加人KSCN显血红色的溶液中存在大量铁离子,四种离子之间不反应,都不与铁离子反应;
D.加入Al能放出大量H2的溶液中存在大量氢离子或氢氧根离子,铵根离子、碳酸氢根离子与氢氧根离子反应,碳酸氢根离子还能够与氢离子反应.
解答 解:A.pH=0的溶液中存在大量氢离子,ClO-与氢离子结合生成次氯酸,次氯酸能够氧化CH3CHO,在溶液中不能大量共存,故A错误;
B.c(H+)=10-12mol•L-1的溶液中存在大量氢氧根离子,NH4+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.加人KSCN显血红色的溶液中存在大量Fe3+,Br-、NO3-、SO42-、Mg2+之间不发生反应,都不与Fe3+反应,在溶液中能够大量共存,故C正确;
D.加入Al能放出大量H2的溶液为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,NH4+与氢氧根离子反应,HCO3-既能够与氢离子,也能够与氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选C.
点评 本题考查了离子共存,题目难度中等,明确题干暗含条件的含义为解答关键,注意熟练掌握常见离子的性质及离子反应发生条件,合理把握离子之间能够共存的情况,试题培养了学生灵活应用基础知识的能力.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋清和淀粉可以用浓硝酸鉴别 | |
| B. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| C. | 分子式为C5H8O2,既与碳酸钠溶液反应又与溴的四氯化碳溶液反应的有机物有8种 | |
| D. | 乳酸薄荷醇酯(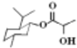 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBrO4的酸性比HClO4的酸性强 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是无色、有毒且无硫化氢稳定的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装 置 | 现 象 |
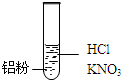 | Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 Ⅲ.试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
| 装置 | 现象 |
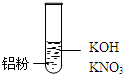 | Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,有刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>D>C | B. | B>D>A>C | C. | D>B>A>C | D. | D>A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通氧气的电极为阳极,发生氧化反应 | |
| B. | 电池放电时,外电路电子由通氧气的正极流向通氢气的负极 | |
| C. | 正极的电极反应为:4OH-→O2↑+2H2O+2e- | |
| D. | 电池工作时,CO${\;}_{3}^{2-}$向负极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com