
如图所示,a、b是多孔石墨电极。某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是( )
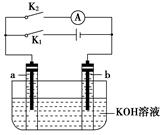
A.断开K2,闭合K1一段时间,溶液的pH变大
B.断开K1,闭合K2时,b极上的电极反应为2H++2e-=H2↑
C.断开K2,闭合K1时,a极上的电极反应为4OH--4e-=O2↑+2H2O
D.断开K1,闭合K2时,OH-向b极移动
B
【解析】
试题分析:该题为原电池和电解池的综合试题。当断开K2,闭合K1时为电解池,此时根据电源判断a极为阳极,b极为阴极,相当于电解水,a极的电极反应为4OH--4e-=O2↑+2H2O,故A、C两项正确;当断开K1,闭合K2时,该装置为原电池,可看作氢氧燃料电池,a极为正极,电极反应为O2+4e-+2H2O=4OH-,b极为负极,电极反应为2H2+4OH--4e-=4H2O,故D项正确,B项错误,所以答案选B。
考点:考查原电池和电解池综合应用的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对学生基础知识的巩固和检验。该题的关键是明确原电池和电解池的工作原理,然后结合装置图灵活运用即可,意在考查学生分析、归纳、总结问题的能力。


科目:高中化学 来源: 题型:
 (2012?西安一模)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
(2012?西安一模)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.| 4×78g/mol |
| ag/cm3.6.02×1023/mol |
| 4×78g/mol |
| ag/cm3.6.02×1023/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省枣庄市高三4月模拟考试(理综)化学部分 题型:填空题
水是宝贵资源,研究生活和工业用水的处理有重要意义。请回答下列问题:
(1)已知水的电离平衡曲线如图所示。A、B、C三点水的电离平衡常数KA、KB、KC关系为 ,若从B点到D点,可采用的措施是 (填序号)。

a。加入少量盐酸
b.加人少量碳酸钠
c.加人少量氢氧化钠
d.降低温度
(2)饮用水中的NO3-主要来自于NH4+。已知在微生物的作用下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

1 molNH4+全部被氧化成NO3-的热化学方程式为 。
(3)某工厂用电解法除去废水中含有的Cr2O72-,总反应方程式为:
Cr2O72-+6Fe+17H2O+2H+
2Cr(OH)3↓+6Fe(OH)3 ↓+6H2↑,该电解反应的负极材料反应的电极式为
,若有9 mol电子发生转移,则生成的cr(OH)3物质的量为
。
(4)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中。常含有较多的NH4+和PO43-,其中一种方法是:在废水中加人镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++NH4++PO43-
MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
水是宝贵资源,研究生活和工业用水的处理有重要意义。请回答下列问题:
(1)已知水的电离平衡曲线如图所示。A、B、C三点水的电离平衡常数KA、KB、KC关系为 ,若从B点到D点,可采用的措施是 (填序号)。
a。加入少量盐酸
b.加人少量碳酸钠
c.加人少量氢氧化钠
d.降低温度
(2)饮用水中的NO3-主要来自于NH4+。已知在微生物的作用下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
1 molNH4+全部被氧化成NO3-的热化学方程式为 。
(3)某工厂用电解法除去废水中含有的Cr2O72-,总反应方程式为:
Cr2O72-+6Fe+17H2O+2H+ 2Cr(OH)3↓+6Fe(OH)3 ↓+6H2↑,该电解反应的负极材料反应的电极式为 ,若有9 mol电子发生转移,则生成的cr(OH)3物质的量为 。
(4)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中。常含有较多的NH4+和PO43-,其中一种方法是:在废水中加人镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++NH4++PO43- MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2011届山东省枣庄市高三4月模拟考试(理综)化学部分 题型:填空题
水是宝贵资源,研究生活和工业用水的处理有重要意义。请回答下列问题:
(1)已知水的电离平衡曲线如图所示。A、B、C三点水的电离平衡常数KA、KB、KC关系为 ,若从B点到D点,可采用的措施是 (填序号)。
(填序号)。
a。加入少量盐酸
b.加人少量碳酸钠
c.加人少量氢氧化钠
d.降低温度
(2)饮用水中的NO3-主要来自于NH4+。已知在微生物的作用下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
1 molNH4+全部被氧化成NO3-的热化学方程式为 。
(3)某工厂用电解法除去废水中含有的Cr2O72-,总反应方程式为:
Cr2O72-+6Fe+17H2O+2H+ 2Cr(OH)3↓+6Fe(OH)3↓+6H2↑,该电解反应的负极材料反应的电极式为 ,若有9 mol电子发生转移,则生成的cr(OH)3物质的量为 。
(4)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中。常含有较多的NH4+和PO43-,其中一种方法是:在废水中加人镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++NH4++PO43- MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com