
| A. | 胶头滴管 | B. | 烧瓶 | C. | 玻璃棒 | D. | 容量瓶 |
分析 配制一定物质的量浓度溶液的配制的步骤:计算、称量、溶解、转移、洗涤、定容、摇匀等,可以根据配制步骤选择使用的仪器,然后判断不需要的仪器.
解答 解:配制一定物质的量浓度的溶液时,需要使用托盘天平、用药匙称量固体或用量筒、滴定管取用液体,然后将称量的固体或液体放在烧杯中加水溶解或稀释,同时使用玻璃棒搅拌,冷却后再将溶解后的溶液转移到容量瓶中,下一步进行定容,最后定容时需要使用胶头滴管,所以需要的仪器有:托盘天平和药匙(或量筒)、烧杯、玻璃棒、容量瓶、胶头滴管,配制过程中不需要烧瓶,
故选B.
点评 本题考查了配制一定物质的量浓度的溶液中仪器选用方法,题目难度不大,解题关键是明确配制一定浓度的溶液步骤,然后根据配制步骤判断使用的仪器.


科目:高中化学 来源: 题型:选择题
| A. | pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1 | |
| B. | NH4HSO4液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2 c(SO42-) | |
| C. | 已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka•Kh=Kw | |
| D. | pH相等的四种溶液:a.CH3COONa;b.Na2CO3;c.NaHCO3;d.NaOH,其溶液物质的量浓度由小到大顺序为d、b、a、c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 火药使用 | 粮食酿酒 | 转轮排字 | 铁的冶炼 |
 |  |  |  |
| 用品 |  |  |  |  |
| 有效成分 | NaCl | NaOH | NaHCO3 | Ca(ClO)2 |
| 用途 | 做调味品 | 做治疗胃病的抗酸药 | 做发酵粉 | 做消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | Ca(HCO3)2溶液中加足量NaOH溶液:HCO${\;}_{3}^{-}$+Ca2++OH-═CaCO3↓+H2O | |
| C. | 用NaOH溶液吸收Cl2:Cl2+2OH-═Cl-+ClO${\;}_{3}^{-}$+H2O | |
| D. | 明矾常用于净水:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与氯化亚铁溶液的反应:Cl2+2Fe2+═2Cl-+2Fe3+ | |
| B. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| C. | 三氯化铁溶液与氢氧化钡溶液反应:FeCl3+3OH-═Fe(OH)3↓+3Cl- | |
| D. | 锌粒与稀醋酸反应:Zn+2H+═Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32 g氧气和臭氧混合气体中所含有的氧原子数为2NA | |
| B. | 标准状况下,22.4 L水所含的原子数为3NA | |
| C. | 1mol•L-1 Na2 CO3溶液中含有的钠离子数为2NA | |
| D. | 5.6 g铁与足量的盐酸反应失去的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=6.2×10-10 | K=4.2×10-7 | K=6.61×10-4 |
| A. | 氟化钠溶液中通入C02:2F-+H2O+CO2═2HF+CO32- | |
| B. | NaCN与HCN的混合溶液中:2c(Na+)═c(CN-)+c(HCN) | |
| C. | 25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者 | |
| D. | 三种酸的酸性由强到弱为:HF>H2C03>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
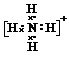 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com