
已知2A2(g)+B2(g) 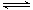 2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
(1)比较a___________b填“>”、“=”、“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将_____________(“增大”、“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是
A.V(C3)=2V(B2) B.容器内气体压强保持不变
C.V逆(A2)=2V正(B2) D.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届河北省高三上11月月考化学卷(解析版) 题型:选择题
在一个容积为2L的密闭容器中,加入0.8molA2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+ B2(g)
B2气体,一定条件下发生如下反应:A2(g)+ B2(g)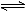 2AB(g)ΔH<0
2AB(g)ΔH<0 ,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
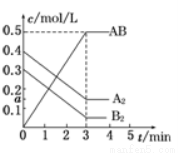
A.图中a点的值为0.1 5
5
B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小
D.平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:填空题
空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3和CO等物质。
(1)烟气的脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点。
选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=﹣905.5kJ/mol
N2(g)+O2(g)=2NO(g) △H= +180kJ/mol
则4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H=
②在催化剂作用下,尿素[CO(NH2)2]也可以将NOx反应生成N2和H2O。写出CO(NH2)2与NO2反应的化学方程式 。
(2)电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应是 。
(3)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(4)废水中含氮化合物的处理方法有多种。
①用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是__________。
②用H2催化还原法可降低水中NO 的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向AgNO3溶液中逐滴加入过量氨水
④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①④
C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
已知吸热反应2CO(g)= 2C(s)+O2(g),设ΔH 和ΔS不随温度 而变,下列说法中正确的是
而变,下列说法中正确的是
A.低温下能自发进行 B.高温下能自发进行
C.任何温度下都能自发进行 D.任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
证明氟化氢是弱电解质的事实是
A.氟化氢在所有卤化氢中热稳定性最强
B.浓H2SO4加入氟化钙固体中,加热,有氟化氢气体产生
C.100 mL0.1mol/L氢氟酸中c(H+)小于0.1mol/L
D.测得常温下0.1mol/LNaF溶液的pH>7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
关于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是
A.该酸式盐的水溶液一定显酸性
B.在该盐溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.若HY-能水解,水解方程式为:HY-+H2O Y2-+H3O+
Y2-+H3O+
D.若HY-能电离,电离方程式为:HY-+H2O Y2-+H3O+
Y2-+H3O+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海省高二11月月考化学试卷(解析版) 题型:选择题
在恒温、恒容下发生反应:A(s)+B(g) = C(g)+D(g) △H<0。则下列判断正确的是( )
A.向该容器中加入少量A,反应速率增大
B.向该容器中充入氩气,反应速率增大
C.将粉末状A代替块状A能加快反应
D.该反应为放热反应,无需加热即可发生
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:填空题
在实验室模拟工业上以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
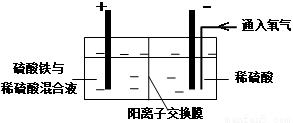
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 _____________。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是_____________。(使用化学用语作答)
(2)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 _____________;加入有机萃取剂的目的是___________________。
(3)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 _____________。
(4)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ___________________。(忽略电解前后溶液体积的变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com