
钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是( )
A.氧化性:ClO –>I2>SO42– B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色 D.次氯酸钠可以与亚硫酸钠共存
【知识点】氧化还原反应规律 氯及化合物的性质B3 D2
【答案解析】D 解析:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,说明次氯酸根能氧化碘离子,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,说明亚硫酸钠能将碘单质还原,A、根据氧化剂的氧化性强于氧化产物,故A正确;B、漂白粉溶液可使碘化钾使淀粉碘化钾试纸变蓝,故B正确;C、向氯水中加入亚硫酸钠溶液,亚硫酸钠能将氯水还原,氯水褪色,故C正确;D、次氯酸钠与亚硫酸钠会发生氧化还原反应,不能共存,故D错误。
故答案选D
【思路点拨】本题考查氧化还原反应规律,关键是根据题目描述得到氧化性顺序:ClO –>I2>SO42– 。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法不正确的是
A、在汽车排气管上加装“催化转化器”可以减少有害气体的排放
B、“84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感
C、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物",PM2.5在空气中有可能形成胶体
D、绿色化学的核心是应用化学原理对环境污染进行治理
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计和结论相符的是
A.加入NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝气体,则一定含有NH4+
B.将SO2通入溴水,溴水褪色,说明SO2具有漂白性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeC12杂质的FeCl3溶液中通入足里C12后,充分加热除去过量的C12,即可得到较纯净的FeC13溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活息息相关,下列说法不正确的是
A.干燥的Cl2和氯水均能使鲜花褪色
B.Si可用于制造半导体材料
C.次氯酸钠溶液是生活中常用的消毒剂
D.经常食用含明矾的食品能中和过多的胃酸
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 。1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol·L- 1 硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为
98%的浓硫酸 mL。
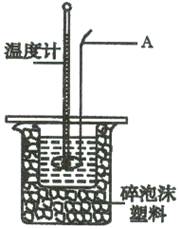
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为 ;
(3)装置中碎泡沫塑料的作用是 ;
(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1)
;
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为 ℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c= 4.18 J·(g·℃)- 1 。则中和热△H= (取小数点后一位)。
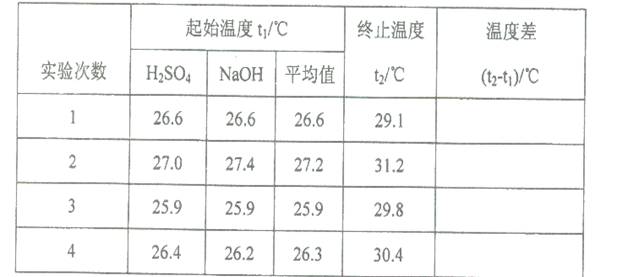
③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。
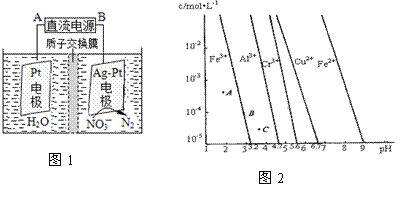

(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
往甲、乙、丙、丁四个烧杯内分别放入0.1 mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100 mL 的水,搅拌,使固体完全溶解。则甲、乙、丙、丁溶液中溶质的质量分数大小的顺序是 ( )
A.甲<乙<丙<丁 B.甲=丁<乙=丙 C.丁<甲<乙=丙 D.丁<甲<乙<丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com