
分析 (1)根据碘化亚铜的溶度积计算出碘离子的浓度;
(2)根据化合价升降相等配平反应方程式;高锰酸钾能够将碘离子氧化成碘单质;
(3)I2+2S2O32-=2I-+S4O62-反应结束时,溶液中碘单质消失,溶液变成无色;
(4)根据题中反应找出关系式2MnO4-~5C2O42- 2S2O32-~I2~2Cu2+,利用滴定数据求出n(C2O42-)、n(Cu2+),然后利用电荷守恒求出钾离子的物质的量,再利用样品质量算出水的物质的量,最后计算出样品晶体的组成.
解答 解:(1)CuI的Ksp=1.27×10-12=c(Cu+)•c(I-),c(I-)=$\frac{Ksp}{c(C{u}^{+})}$=$\frac{1.27×1{0}^{-12}}{c(C{u}^{+})}$,由于溶液中c(Cu+)≤1.0×10-6mol•L-1,c(I-)≥1.27×10-6,
故答案为:1.27×10-6;
(2)锰元素化合价+7→+2,降低了5价,生成氧气,氧元素化合价-2→0,升高了2×2=4,所以锰离子前配4,氧气前配5,再利用观察法配平其它物质,反应的离子方程式是:4MnO4-+12H+ $\frac{\underline{\;\;△\;\;}}{\;}$4Mn2++5O2↑+6H2O;若不加热除去高锰酸根离子,高锰酸根离子能够氧化碘离子,使得碘单质的物质的量增加,测定铜离子含量偏高,
故答案为:4MnO4-+12H+ $\frac{\underline{\;\;△\;\;}}{\;}$4Mn2++5O2↑+6H2O;偏高;
(3)根据反应I2+2S2O32-=2I-+S4O62-,当反应结束时,溶液的蓝色消失变成无色溶液,所以滴定终点是:溶液由蓝色变为无色,且半分钟内不变色,
故答案为:溶液由蓝色变为无色,且半分钟内不变色;
(4)根据反应2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑、2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
可得关系式:2MnO4-~5C2O42- 2S2O32-~I2~2Cu2+
2 5 2 2
0.2×8×10-3mol n(C2O42-) 0.25×8×10-3mol n(Cu2+)
所以n(C2O42-)=4×10-3mol,n(Cu2+)=2×10-3mol,
根据电荷守恒原理:n(K+)=2n(C2O42-)-2n(Cu2+)=4×10-3mol
根据质量守恒原理:m(H2O)=0.6720-39×4×10-3-64×2×10-3-88×4×10-3=0.036g
n(H2O)=2×10-3,n (K+):n(Cu2+):n(C2O42-):n (H2O)=2:1:2:1,
所以样品晶体组成是:K2Cu(C2O4)2•H2O,
答:该样品晶体的化学式为:K2Cu(C2O4)2•H2O.
点评 本题考查了探究物质组成方法,题目的综合性较强,计算量稍大,充分考查了学生分析、理解信息、利用信息的能力,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 氯气和液氯是两种不同物质 | |
| B. | 新制氯水溶液中存在两个平衡状态 | |
| C. | 久置的氯水,溶液的PH会变小 | |
| D. | 向氯水中滴加紫色石蕊试剂,溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和的FeCl3溶液滴入沸水中形成Fe(OH)3胶体 | |
| B. | 蛋白质溶液可观察到丁达尔现象 | |
| C. | Fe(OH)3胶体可观察到丁达尔现象 | |
| D. | 胶体分散系中所有粒子的直径都不在1~100 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳元素 | B. | 氢元素 | C. | 氧元素 | D. | 氢、氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,
, ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体 | |
| B. | 氧化铝的熔点很高,可用于制造熔融烧碱的坩埚 | |
| C. | 在含FeC12杂质的FeCl3溶液中通入足量C12后,充分加热除去过量的C12,不能得到纯净的FeC13溶液 | |
| D. | 饱和氯水既有酸性又有漂白性,加入适量NaHCO3固体,其漂白性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
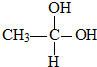 →CH3-CHO+H2O
→CH3-CHO+H2O
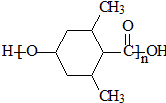 ]
]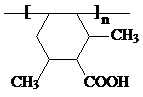 ;
;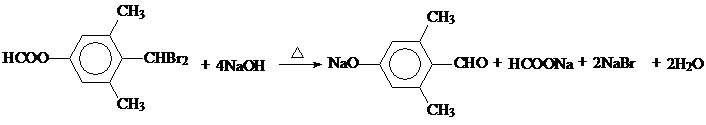 ;
; ;
;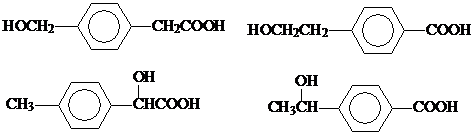 (任写一个).
(任写一个).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com