
往容积为10 L的密闭容器内通入40 mol N2和120 mo l H2,在一定条件下进行反应,经2s后达到平衡状态,平衡时c(N2)为2 mol/L。
l H2,在一定条件下进行反应,经2s后达到平衡状态,平衡时c(N2)为2 mol/L。
(1)用H2的浓度变化表示2 s内的平均速率v(H2)=__________。
(2)氮气的转化率是__________ 。
(3)平衡时混合气体中氨的体积分数是__________ 。
(4)反应开始与平衡时的压强之比是 。
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧,质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法:
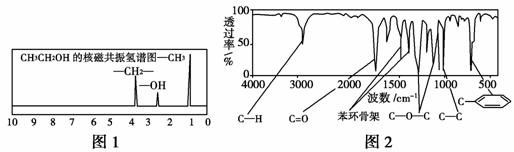
方法一:核磁共振仪可以测定有机物分子里不同化学环境的氢原子及其相对数量。如乙醇(CH3CH2OH)的核磁共振氢谱有3个峰,其面积之比为3∶2∶1,如图1所示,现测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图2所示。
已知:A分子中只含一个苯环,且苯环上只有一个取代基,试回答下列问题:
(1)A的分子式为:_______________________________________________;
(2)A的结构简式为:______________________________________________;
(3)A的芳香类同分异构体有多种,请按要求写出其中两种结构简式:
①分子中不含甲基的芳香酸:______________________________________;
②含羟基且苯环上只有两个取代基的芳香醛:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流。下列叙述正确的是 ( )
①通入CH4的电极为正极 ②正极的电极反应式为O2+2H2O+4e-===4OH- ③通入CH4的电极反应式为CH4+2O2+4e-===CO2+2H2O ④负极的电极反应式为CH4+10OH--8e-===CO +7H2O ⑤放电时溶液中的阳离子向负极移动 ⑥放电时溶液中的阴离子向负极移动
+7H2O ⑤放电时溶液中的阳离子向负极移动 ⑥放电时溶液中的阴离子向负极移动
A.①③⑤ B.②④⑥
C.④⑤⑥ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
在离子RO3n—中共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
A.A-x+n+48 B.A-x+n+24
C.A-x-n-24 D.A+x-n-24
查看答案和解析>>
科目:高中化学 来源: 题型:
对于以下反应:A(s)+3B(g) 2C(g)+D(g),在一定温度、体积固定的密闭容器中进行,下列叙述中能说明上述反应达到平衡状态的是
2C(g)+D(g),在一定温度、体积固定的密闭容器中进行,下列叙述中能说明上述反应达到平衡状态的是
A.混合气体的密度不随时间变化而变化
B. 3v正(B)= v逆(D)
C.D的物质的量分数在混合气体中保持不变
D.B、C、D的分子个数之比为3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.油脂和蛋白质均属于高分子化合物
B.二氧化硅是太阳能电池的主要材料
C. 、
、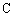 、S都能直接与氧气反应,生成两种相应的氧化物
、S都能直接与氧气反应,生成两种相应的氧化物
D.蔗糖、麦芽糖的分子式都是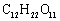 ,二者互为同分异构体
,二者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是
A.NaOH溶液中加入铝片:Al+2OH-=AlO2-+H2↑
B.NaHCO3溶液水解:HCO3-+H2O H3O+ +CO32-
H3O+ +CO32-
C.NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-=CO32-+H2O
D.硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
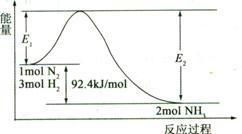
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的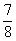 ,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H=+1530 kJ/mol
H=+1530 kJ/mol
又知:H2O(1)=H2O(g)  H=+44.0 kJ/mol
H=+44.0 kJ/mol
则2N2(g)+6H2O(g)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸分子的结构式为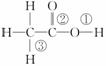 ,下列反应及断键部位正确的是( )
,下列反应及断键部位正确的是( )
(1)乙酸的电离,是①键断裂;
(2)乙酸与乙醇发生酯化反应,是②键断裂;
(3)在红磷存在时,Br2与CH3COOH的反应:CH3COOH+Br2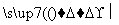 CH2Br—COOH+HBr,是③键断裂;
CH2Br—COOH+HBr,是③键断裂;
(4)乙酸变成乙酸酐的反应: 2CH3COOH―→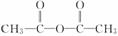 +H2O,是①②键断裂
+H2O,是①②键断裂
A.(1)(2)(3) B.(1)(2)(3)(4) C.(2)(3)(4) D.(1)(3)(4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com