
【题目】工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下。
主反应 2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反应CH3CH2OH![]() H2C=CH2↑+H2O
H2C=CH2↑+H2O

【乙醚制备】装置设计如下图(部分装置略)

(1)仪器a是__________(写名称);仪器b应更换为下列的_______(填序号)。
A.干燥器 B.直形冷凝管 C.玻璃管 D.安全瓶
(2)实验操作的正确排序为___________(填序号),取出乙醚立即密闭保存。
a.安装实验仪器 b.加入12mL浓硫酸和少量乙醇的混合物c.检查装置气密性
d.熄灭酒精灯 e.通冷却水并加热烧瓶 f.拆除装置 g.控制滴加乙醇速率与馏出液速率相等 (3)加热后发现a中没有添加碎瓷片,处理方法是___________________;反应温度不超过145℃,其目的是___________________________。若滴入乙醇的速率显著超过馏出液速率,反应速率会降低,可能原因是__________________________。
【乙醚提纯】

(4)粗乙醚中含有的主要杂质为_____________;无水氯化镁的作用是_____________________。
(5)操作a的名称是____;进行该操作时,必须用水浴代替酒精灯加热,其目的与制备实验中将尾接管支管通入室外相同,均为___________。
【答案】 三颈烧瓶 B a c b e g d f 停止加热,将烧瓶中的溶液冷却至室温,再重新加入碎瓷片 避免副反应发生 温度骤降导致反应速率降低 乙醇 干燥乙醚 蒸馏 避免引发乙醚蒸汽燃烧或爆炸
【解析】(1)仪器a是三颈烧瓶;仪器b是球形冷凝管,为避免冷凝时积液,应更换为直形冷凝管,答案选B; (2)实验操作的正确排序为a.安装实验仪器→c.检查装置气密性→b.加入12mL浓硫酸和少量乙醇的混合物→e.通冷却水并加热烧瓶→g.控制滴加乙醇速率与馏出液速率相等→d.熄灭酒精灯→f.拆除装置,取出乙醚立即密闭保存。即答案为a c b e g d f;(3)加热后发现a中没有添加碎瓷片,处理方法是停止加热,将烧瓶中的溶液冷却至室温,再重新加入碎瓷片;反应温度不超过145℃,其目的是避免副反应发生;若滴入乙醇的速率显著超过馏出液速率,反应速率会降低,可能是温度骤降导致反应速率降低;(4)粗乙醚中含有的主要杂质为未反应的乙醇;无水氯化镁的作用是干燥乙醚;(5)操作a的名称是蒸馏;进行该操作时,必须用水浴代替酒精灯加热,其目的与制备实验中将尾接管支管通入室外相同,均为避免引发乙醚蒸汽燃烧或爆炸。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】只改变一个影响因素,平衡常数K与平衡移动的关系叙述不正确的是
A.K值不变,平衡可能移动
B.平衡向右移动时,K值不一定移动
C.K值有变化,平衡一定移动
D.相同条件下,同一个反应的方程式的化学计量数增大2倍,K值也增大两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如图:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是______________________。
(2)滤渣的主要成分为TiO2xH2O,写出TiOSO4水解生成TiO2xH2O的化学方程式为_____。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为______________。
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因____________________________。
(5)步骤④的离子方程式为___________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_________。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列微粒之间,属于同位素的是(填字母),属于同素异形体的是 , 属于同一种物质的是 . A.红磷和白磷 B.氕和氚 C.氯气和液氯 D.冰和干冰 E.氧气和臭氧 H.13C和14C.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:①氯化铵 ②氦气 ③氯化镁 ④二氧化碳 ⑤过氧化氢 ⑥氯化钠 ⑦过氧化钠 其中:a.只含离子键的物质是(填编号,下同)
b.只含共价键的物质是
c.既有离子键又共价键的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g)![]() CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5 kJ/mol、285.5 kJ/mol、283.0 k J/mol,则x=____;为提高合成甲醇反应的选择性,关键因素是__________________________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应,相关数据如图一。
①该化学反应0~10 min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是_____(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为______。

③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是________________。
(3)干燥的甲醇可用于制造燃料电池。
①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为______________________________;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
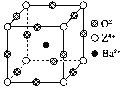
(1)Y在周期表中位于________________;
(2)与钡同族的镁钙锶的碳酸盐受热分解的温度从上至下逐渐_______填“升高”或“降低”),原因是______________________________。
(3)①制备M的化学方程式是__________________________________。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________。
③在M晶体中,Z4+的氧配位数为________。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____________________m。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 澄清透明溶液中:K+、Cu2+、ClO-、S2-
B. 0.1 mol·L-1 (NH4)2CO3溶液中:K+、Na+、NO3-、OH-
C. pH=1的溶液中:Na+、Mg2+、AlO2-、NO3-
D. ![]() =10-13 mol·L-1的溶液中:Na+、K+、SO42-、CO32-
=10-13 mol·L-1的溶液中:Na+、K+、SO42-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com