
����Ŀ��һ���¶ȣ�t�棩�£���1 L�ܱ�������ͨ��H2�� I2��0.15 mol���������·�Ӧ�� H2(g) + I2(g) ![]() 2HI(g)����H<0 һ��ʱ���ﵽƽ�⣬����������£�
2HI(g)����H<0 һ��ʱ���ﵽƽ�⣬����������£�
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
��ش�
��1����Ӧ����___________���Ӵﵽƽ��״̬��
��2��2 min�ڣ�v(H2) =______________mol/(L��min)��
��3��������֤���÷�Ӧ�Ѿ��ﵽƽ�����________������ĸ����
a. v��(H2)= v�� (HI) b. ����������ɫ���ٷ����仯
c. ��������и���ֵ����ʵ������ٷ����仯 d. ���������ܶȲ��ٱ仯��
��4���ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ_______________����H2��ƽ��ת������__________________��
��5�������¶ȣ���ѧƽ�ⳣ��KҪ___________������С������
��6�����¶ȣ�t�����£�����ʼͨ��һ������H2�� I2����Ӧ�ﵽƽ��ʱ�����c(H2)=0.4mol/L��c(I2)=0.9mol/L����ƽ��ʱc(HI)=______________mol/L.
���𰸡�7 0.015 bc K=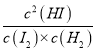 33.3% ��С 0.6
33.3% ��С 0.6
��������
(1)��Ӧ����7���Ӻ�I2�����ʵ���Ũ�Ȳ�����ʱ��仯���仯��˵����Ӧ�ﵽƽ��״̬��
(2)2min�ڣ�v(I2)=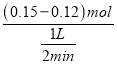 =0.015mol/(Lmin)������֮�ȵ��ڻ�ѧ������֮�ȣ���v(H2)=v(I2)=0.015mol/(Lmin)��
=0.015mol/(Lmin)������֮�ȵ��ڻ�ѧ������֮�ȣ���v(H2)=v(I2)=0.015mol/(Lmin)��
(3)a��Ӧ��2v��(H2)=v��(HI)ʱ��Ӧ����ƽ��״̬����a����
b������������ɫ���ٷ����仯��˵����������Ũ�Ȳ��䣬��Ӧ����ƽ�⣬��b��ȷ��
c����������и���ֵ����ʵ������ٷ����仯��˵������ƽ�⣬��c��ȷ��
d������������������䣬�������������䣬���������ܶ�ʼ�ղ��䣬��d����
�ʴ�Ϊbc��
(4) H2(g) + I2(g) ![]() 2HI(g)��
2HI(g)��
��ʼ���ʵ���Ũ��(mol/L) 0.15 0.15 0
�仯���ʵ���Ũ��(mol/L) 0.05 0.05 0.10
ƽ�����ʵ���Ũ��(mol/L) 0.10 0.10 0.10
�ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=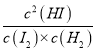 =
=![]() =1��
=1��
��H2��ƽ��ת������![]() =33.3%��
=33.3%��
(5)�˷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����ѧƽ�ⳣ��KҪ��С��
(6)���¶�(t��)�£�ƽ�ⳣ��K=1����K=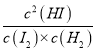 =
=![]() =1����ã�c(HI)=0.6mol/L��
=1����ã�c(HI)=0.6mol/L��


 С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȡ1,2���������飬�����Ʊ���������õ���(����)
A. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
C. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
D. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.�������ʣ�������������Һ������Ƭ����Һ̬HCl ���������ǡ������ڵ�NaCl����SO2 ���塢��̼�����ơ� ��������
��1�����ڵ���ʵ���______________________�������ţ�
��2���ܵ������____________________________________�������ţ�
��3���ٺ͢ڷ�Ӧ�����ӷ���ʽ________________________________��
II.ʵ���ҿ�ͨ��K2Cr2O7��Һ�ⶨ��������FeSO4�ĺ�������Ӧ����K2Cr2O7 +��FeSO4 +��H2SO4 =��Cr2(SO4)3+��Fe2(SO4)3+��K2SO4+��H2O
��1����ƽ��������ʽ�����ڷ���ʽ��������˫��������������ת�Ƶķ������Ŀ��_______________
��2���÷�Ӧ�Ļ�ԭ����Ϊ__________������Ӧ������1 mol K2Cr2O7����ת�Ƶ�����Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ӡˢ��·���Һ(��Ҫ�ɷ���Cu2+��Fe2+��Fe3+��H+��Cl-)���������Ʊ���ʽ̼��ͭ��������ͼ��
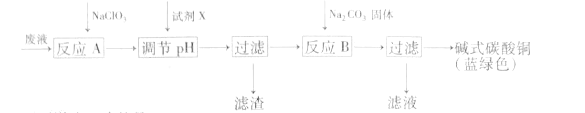
����˵����ȷ���ǣ� ��
A.��ӦA�����ӷ���ʽΪ��10Fe2++2ClO3-+12H+=10Fe3++Cl2��+6H2O
B.ͭ�ڿ����б���ʴ�õ�ͭ�⣬����Ҫ�ɷ��Ǽ�ʽ̼��ͭ
C.NaClO3��Na2CO3����ԭ���ӻ����;�Ϊsp3�ӻ�
D.�Լ�X��ΪCuO����Ҫ������ͨ������pHֵ��Fe2+ת��ΪFe(OH)3���˳�ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3.2g CH3OH(l)��ȫȼ������Һ̬ˮ��CO2���ų�72.576 kJ�������������Ȼ�ѧ����ʽ��ȷ����
A.CH3OH(l)��![]() O2(g)===CO2(g)��2H2O(l) ��H �� - 72.576 kJ��mol��1
O2(g)===CO2(g)��2H2O(l) ��H �� - 72.576 kJ��mol��1
B.CH3OH(l)��![]() O2(g)===CO2(g)��2H2O(g) ��H �� - 72.576 kJ��mol��1
O2(g)===CO2(g)��2H2O(g) ��H �� - 72.576 kJ��mol��1
C.2CH3OH(l)��3O2(g)===2CO2(g)��4H2O(l) ��H �� - 1451.52 kJ��mol��1
D.CH3OH(l)��![]() O2(g)===CO2(g)��2H2O(l) ��H �� + 725.76 kJ��mol��1
O2(g)===CO2(g)��2H2O(l) ��H �� + 725.76 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڱ���2008����˻��ϱ����ã�����һ���˷ܼ�����ṹ��ʽ��ͼ��ʾ������������ȷ����
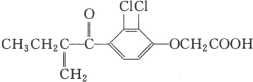
A.���л������ʽΪC13H16O4Cl2
B.1 mol����������6 mol H2�����ӳɷ�Ӧ
C.��������ʹ��ˮ��ɫ
D.���������벻����NaOH��Һ������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO4)��һ���Ϻ�ɫ���壬ֻ���ڼ��Ի������ȶ����ڣ������Ի��������ֽ⣬��ҵ��ͨ�������Ƶø���������ת��Ϊ������ء�
I.�Ʊ�NaCIO��Һ
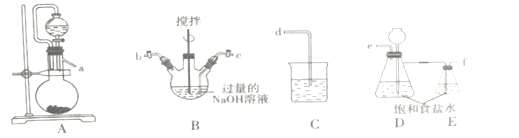
��1��װ�õ�����˳��Ϊa��___��d��
��2��װ��D������___��
��3��Bװ�÷�Ӧ������Ҫ�ϸ�����¶ȣ��¶ȹ���������NaClO3��д������NaClO3�����ӷ���ʽ___��
II.�Ʊ�K2FeO4
��1��ʪ���Ʊ�K2FeO4����Fe(NO3)3��Һ�μӵ�װ��B�Ļ����Һ�У��䷴Ӧ�����ӷ���ʽ��___��������Ӧ�����Һ�м���KOH���������Ϻ�ɫ���壬����ת���ܷ�����ԭ����___(�ü�Ҫ������˵��)��
��2����ⷨ�Ʊ�K2FeO4(��ͼ)��

��װ�������ӽ���ĤΪ___���ӽ���Ĥ(���������")�������缫��ӦʽΪ___��
III.K2FeO4���ʵ�̽��
ȡ�������Һ�μ�ϡ���ᣬ�ռ�������ɫ���塣���������������λͬѧ��������²��룺
�ף�����ֻ����Cl2��
�ң������Cl2�����___�������ʵ��֤����ͬѧ�IJ²�___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᴿ�ǻ�ѧʵ���е���Ҫ���֣������й��ˡ���������ȡ������ȣ�Ӧ�ù㷺����������ˮ�Ǻϳɻ���ϩ�ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ����ͼ��
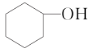
![]()
![]() +H2O
+H2O
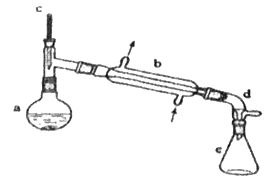
�����õ����й��������£�
��Է������� | �ܶ�/gcm-3 | �е�/�� | �ܽ��� | |
������ | 100 | 0.9618 | 161 | ����ˮ |
����ϩ | 82 | 0.8102 | 83 | ������ˮ |
��.�ϳɷ�Ӧ��
��a�м���20g��������2СƬ���Ƭ����ȴ��������������1 mLŨ���ᣬb��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90 �档
��.�����ᴿ��
��Ӧ�ֲ��ﵹ���Һ©���зֱ�������5 %̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ10 g��
�ش��������⣺
(1)װ��b��������__________________��
(2)�������Ƭ��������_____________���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������___________(����ĸ)��
A.�������� B.��ȴ�� C.���貹�� D.��������
(3)��Һ©����ʹ��ǰ����ϴ�ɾ���________���ڱ�ʵ���������У�����Ӧ�ôӷ�Һ©����__________(��Ͽڵ��������¿ڵ�����)��
(4)�ڻ���ϩ�ֲ�����������У��������õ���������_______(����ȷ�𰸱��)��
A.������ƿ B.�¶ȼ� C.��Һ©�� D.ţ�ǹ� E.��ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�������������Ȼ�ѧ����ʽC2H2(g)+ ![]() O2(g) ��2CO2(g)+H2O(l) ����H=��1 300 kJ��mol��1��˵���У���ȷ����(����)
O2(g) ��2CO2(g)+H2O(l) ����H=��1 300 kJ��mol��1��˵���У���ȷ����(����)
A.��5NA������ת��ʱ���÷�Ӧ�ų�1 300 kJ������
B.��1NA��ˮ����������ΪҺ��ʱ������1 300 kJ������
C.��2NA��̼�����õ��Ӷ�����ʱ���ų�1 300 kJ������
D.��8NA��̼�����õ��Ӷ�����ʱ���ų�1 300 kJ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com