
| A. | 凡是分子组成相差一个或几个“CH2”原子团的物质,彼此一定是同系物 | |
| B. | 两种化合物的组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 | |
| C. | 凡是含碳元素的化合物都属于有机化合物 | |
| D. | 有机化合物的同分异构现象是有机化合物种类繁多的重要原因之一 |
分析 A.同系物的结构相似;
B.组成元素相同,各元素质量分数也相同,最简式相同;
C.碳的氧化物、碳酸盐等属于无机物;
D.分子中碳原子越多,同分异构体越多.
解答 解:A.同系物的结构应相似,如苯酚、苯甲醇相差一个CH2原子团的物质,不是同系物,故A错误;
B.组成元素相同,各元素质量分数也相同,最简式相同,如乙炔、苯不是同分异构体,故B错误;
C.碳的氧化物、碳酸盐等属于无机物,则含碳元素的化合物不一定都是有机化合物,故C错误;
D.分子中碳原子越多,同分异构体越多,一种分子可能有多种同分异构体,则同分异构现象是有机化合物种类繁多的重要原因之一,故D正确.
故选D.
点评 本题考查有机物的官能团及结构,为高频考点,把握物质的组成、同系物、同分异构体的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

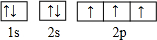 ,这样排布遵循了构造原理、泡利原理和洪特规则.
,这样排布遵循了构造原理、泡利原理和洪特规则.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素被人体消化吸收后提供营养物质 | |
| B. | 能发生水解反应的不一定是糖类,但糖类一定能发生水解反应 | |
| C. | 没有成熟的苹果汁遇碘变蓝色,成熟的苹果汁能还原新制氢氧化铜悬浊液 | |
| D. | 1 mol二糖完全水解一定能够生成2 mol葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 :下列有关该化合物的说法中正确的是( )
:下列有关该化合物的说法中正确的是( )| A. | 分子式为C12H8O2Cl4 | B. | 是一种可溶于水的气体 | ||
| C. | 是最危险的致癌物之一 | D. | 是一种多卤代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和石油的分馏均属物理变化 | |
| B. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| D. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a时正反应速率比逆反应速率小 | |
| B. | 点d:v正(H2)=3v逆(N2) | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点c处反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硝酸钾溶于水 | |
| B. | 氨气和氯化氢反应生成氯化铵晶体 | |
| C. | 水蒸气凝结为液态的水 | |
| D. | (NH4)2CO3分解生成二氧化碳、氨气和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 0.5mol•L-1 CH3COONa 与6mL 1mol•L-1 盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]>c[(NH4)2CO3]>c(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| N>O | O2->Al3+ | KCl>硫黄 | H2SO4<HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com