
【题目】用6mol·L-1的硫酸配制100mL1mol·L-1硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.20mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)__。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)__。
A.使用容量瓶前检查它是否漏水B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm~2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
【答案】G、E、C、H、F或E、G、C、H、F B、C、D
【解析】
(1)配制溶液时,选用仪器的先后顺序,也是按照配制操作的先后顺序进行选择,即按照计算、量取、溶解、转移、定容进行选择。
(2)A.使用容量瓶之前,必须检验容量瓶是否漏液;
B.用容量瓶配制溶液,应确保溶质的物质的量不变;
C.配制溶液时,称好的固体应先放在烧杯内溶解,冷却至室温后才能转移入容量瓶;
D.配制溶液时,量好的液体试样,也应先放在烧杯内溶解,冷却至室温后再转移入容量瓶内;
E.定容时,应盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒、摇匀。
(1)配制溶液时,通过计算,确定所需6mol·L-1的硫酸的体积为![]() ,应选择20mL量筒、50mL烧杯;然后是转移,用到玻璃棒,100mL容量瓶;定容时用到胶头滴管,由此确定选用仪器的先后顺序为G、E、C、H、F或E、G、C、H、F;答案为:G、E、C、H、F或E、G、C、H、F;
,应选择20mL量筒、50mL烧杯;然后是转移,用到玻璃棒,100mL容量瓶;定容时用到胶头滴管,由此确定选用仪器的先后顺序为G、E、C、H、F或E、G、C、H、F;答案为:G、E、C、H、F或E、G、C、H、F;
(2)A.使用容量瓶之前,必须检验容量瓶是否漏液,A正确;
B.用容量瓶配制溶液,用待配溶液润洗,必然导致溶质的物质的量增大,所配浓度偏大,B不正确;
C.配制溶液时,称好的固体应先放在烧杯内溶解,不能直接倒入容量瓶,C不正确;
D.配制溶液时,量好的液体试样,也应先放在烧杯内溶解,不能直接倒入容量瓶,D不正确;
E.定容时,应盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒、摇匀,E正确。
由此得出,在容量瓶的使用方法中,操作不正确的是B、C、D。答案为:B、C、D。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】氯化钴渗入水泥中可以制备彩色水泥(变色水泥)。以某废钴渣(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO和SiO2)制备氯化钴晶体的一种流程如下:

已知:①在酸性条件下,氧化性:Co3+>Cl2>H2O2>Fe3+。
②当pH=5时,Fe3+、Al3+全部转化为氢氧化物沉淀。请回答下列问题:
(1)滤渣A的主要成分是_______________、_______________(填化学式)。
(2)在滤液A中加入H2O2,H2O2作还原剂的离子方程式为_______________
(3)从滤渣B中提取铁红的操作是将滤渣B溶于过量的_______________溶液(填化学式),_______________、洗涤、灼烧得到铁红。
(4)从环境保护角度分析,溶解废钴渣时不用浓盐酸替代硫酸的原因是:_______________
(5)为了测定CoCl2nH2O中结晶水数目进行如下实验:取16.6g样品在一定条件下脱水得13.0gCoCl2,则n=_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从“南澳一号”沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明。青花瓷胎体的原料--高岭土![]() ,可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石
,可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石![]() ,在
,在![]() 左右一次烧成的釉可形成精美的青花瓷。
左右一次烧成的釉可形成精美的青花瓷。
![]() 高岭土分子中
高岭土分子中![]() ______,青花瓷______
______,青花瓷______![]() 填“属于”或“不属于”硅酸盐产品。
填“属于”或“不属于”硅酸盐产品。
![]() 在“南澳一号”考古直播过程中,需用高纯度
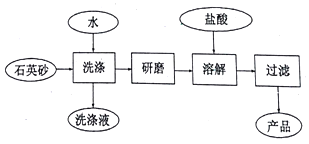
在“南澳一号”考古直播过程中,需用高纯度![]() 制造的光纤。下图是用海边的石英砂
制造的光纤。下图是用海边的石英砂![]() 含氯化钠、氧化铝等杂质
含氯化钠、氧化铝等杂质![]() 制备二氧化硅粗产品的工艺流程。
制备二氧化硅粗产品的工艺流程。
①洗涤石英砂的目的是______。
②在以上流程中,要将洗净的石英砂研磨成粉末,目的是______。
![]() 工业上常用二氧化硅与碳在高温下发生反应制造粗硅,粗硅中含有SiC,生成物中Si和SiC的物质的量之比为1:
工业上常用二氧化硅与碳在高温下发生反应制造粗硅,粗硅中含有SiC,生成物中Si和SiC的物质的量之比为1:![]() 写出其化学方程式______。
写出其化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作与现象、结论都正确且有相关性的是
选项 | 操作 | 现象 | 结论 |
A |
|
| 原溶液中仍有 |
B | 向含有ZnS和 | 生成黑色沉淀 |
|
C | 向 | 溶液变浑浊 | 酸性 |
D | 向乙酸乙酯粗产品中加入少量 | 产生大量气泡 | 乙酸乙酯产品中混有乙醇 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
关于该电池的叙述不正确的是( )

A.该电池不能在高温下工作
B.电池右侧电极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,H+通过质子交换膜向电池右侧迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成CO222.4 L(标况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答下列问题:

(1)B极是电源的___;一段时间后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明___,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为___。
(3)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是___。
(4)现用丙装置给铜件镀银,则H应该是__(填“镀层金属”或“镀件”)。当乙中溶液的pH是13时(乙溶液体积为500mL,不考虑反应过程溶液体积变化),丙中镀件上析出银的质量为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有化合物:
甲: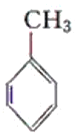 乙:
乙: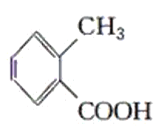 丙:
丙: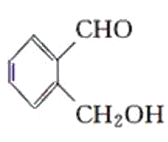
(1)请判别上述哪些化合物互为同分异构体(填序号):____________。
(2)请用一种试剂鉴别甲、乙、丙化合物。在下表中填入所选试剂及主要现象即可。________
试剂 | 现象 | |
甲 | ||
乙 | ||
丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是
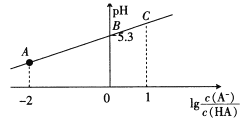
A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com