
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 天然气 | 硫酸 | 醋酸 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 硫酸钡 | 醋酸 | 三氧化硫 |
| C | 胆矾 | 石灰水 | 苛性钾 | 水 | 碳酸钙 |
| D | 硫酸 | 青铜 | 氯化钠 | 氢氧化铁 | 氢气 |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:
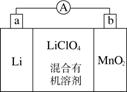
(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为____________________________________。K2MnO4在酸性溶液中歧化,生成KMnO2和MnO2的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取乙烯的装置如图所示,试回答:
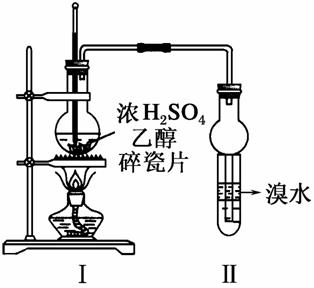
(1)烧瓶中发生反应的化学方程式为_________________________
______________________________________________________________________________________________________________。
(2)实验中发现试管Ⅱ中溴水褪色,此现象能否说明一定有乙烯生成________(填“能”或“不能”)。
试管中另一现象可证明确实有乙烯生成,该现象是__________;试管Ⅱ中溴水褪色能否说明是由于乙烯与溴水发生了加成反应________(填“能”或“不能”)。通过测定反应后溶液的pH可进一步证明是发生了取代反应还是加成反应,原因是__________________
______________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质除杂的方法中可行的是
A.除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤
B.向含有少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液,以除去FeCl2溶液中的FeBr2
C.除去乙酸乙酯中混有的少量乙酸,加入饱和氢氧化钠溶液振荡后分液
D.已知:Ksp(CuS)<Ksp(FeS),可加入过量的难溶电解质FeS,使水中少量的Cu2+转化成硫化物沉淀而除去
查看答案和解析>>
科目:高中化学 来源: 题型:
能在水溶液中大量共存的一组离子是( )
A.H+、I-、NO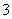 、SiO
、SiO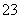
B.Ag+、Fe3+、Cl-、SO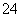
C.K+、SO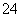 、Cu2+、NO
、Cu2+、NO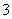
D.NH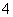 、OH-、Cl-、HCO
、OH-、Cl-、HCO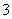
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的装置分别进行如下实验,各组物质反应后,溶液的导电性比反应前明显增强的是( )
A.向亚硫酸钠溶液中通入氯气:Na2SO3+Cl2+H2O===Na2SO4
+2HCl
B.向硝酸银溶液中通入少量氯化氢:AgNO3+HCl===AgCl↓+HNO3
C.向硫化氢饱和溶液中通入少量氧气:2H2S+O2===2H2O+2S↓
D.向NaOH溶液中通入少量氯气:2NaOH+Cl2===NaCl+NaClO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某电镀铜厂有两种废水需要处理,一种废水中含有CN-,另一种废水中含有Cr2O 。该厂拟定如图所示的废水处理流程。
。该厂拟定如图所示的废水处理流程。
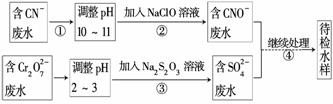
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是___ _____________________________________________________________________。
_____________________________________________________________________。
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因________________________________________________________________________。
(3)②中反应后无气体放出,该反应的离子方程式为
________________________________________________________________________。
(4)③中反应时,每0.4 mol Cr2O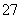 转移2.4 mol e-,该反应的离子方程式为________________________________________________________________________。
转移2.4 mol e-,该反应的离子方程式为________________________________________________________________________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。请你使用化学用语,结合必要的文字解释其原因________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:
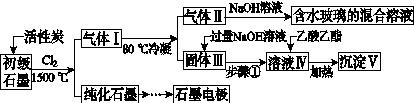
(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是____________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体Ⅰ中的碳氧化物主要为________。由气体Ⅱ中某物得到水玻璃的化学反应方程式为____________________________________________。
(3)步骤①为:搅拌、________。所得溶液Ⅳ中的阴离子有________。
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为______________________________________________,100 kg初级石墨最多可能获得Ⅴ的质量为______kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知丙二醇的结构简式为 ,下列关于丙二醇的说法正确的是( )
,下列关于丙二醇的说法正确的是( )
A.丙二醇可发生消去反应生成丙炔
B.丙二醇可由丙烯在一定条件下与水加成制得
C.丙烯与溴水加成后,再与NaOH醇溶液共热水解可得丙二醇
D.丙二醇在铜存在下催化氧化可得到丙二醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com