
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取Ni2O3.已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如图所示:
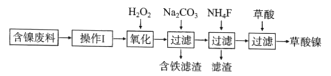
回答下列问题:
(1)“操作I”为“酸浸”,为了提高酸浸的效率,可以采取的措施为__________(写出两条)。
(2)加入H2O2发生的主要反应的离子方程式为________________
(3)加入碳酸钠溶液调pH至4.0~5.0,其目的是___________________
(4)将草酸镍(NiC2O4·2H2O)在热空气中干燥脱水,再采用高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为水蒸气和_________________
(5)工业上还可用电解法制取Ni2O3用NaOH溶液调 NiCl2,溶液的pH至7.5,加入适量Na 2SO4后利用惰性电极电解。电解过程中产生的Cl2,有80%在弱碱性条件下生成CIO-,再把二价镍氧化为三价镍。CIO-氧化Ni(OH)2生成Ni2O3的离子方程式为_______________________amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为_______mol.
(6)以Al和NiO(OH)为电极,NaOH溶液为电解液组成原电池,放电时NiO(OH)转化为Ni(OH)2,则放电时负极的电极反应式为_______________
【答案】将含镍废料粉碎、适当增大稀硫酸的浓度、适当升温、搅拌等方法(任选2种) 2Fe2++ H2O2+2H+= 2Fe3++ 2H2O 促进Fe3+水解沉淀完全 CO、CO2 ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O 1.25a Al+4OH--3e-=AlO2-+2H2O
【解析】
将含镍废料(镍、铁、钙、镁合金为主)进行酸浸,转化为含有Ni2+、Fe2+、Ca2+、Mg2+的浸出液,向浸出液中加入双氧水,将Fe2+转化为Fe3+,再加入碳酸钠,调节溶液pH值,将Fe3+转化为氢氧化铁和碳酸钙沉淀过滤除去,再向滤液中加入NH4F,使Ca2+、Mg2+转化为CaF2、MgF2过滤除去,得到的滤液中加入草酸,将Ni2+转化为NiC2O4·2H2O,据此分析解答。
(1)“操作I”为“酸浸”,为了提高酸浸的效率,可以将含镍废料粉碎、适当增大稀硫酸的浓度、适当升温、搅拌等方法;
(2)加入H2O2,将Fe2+转化为Fe3+,离子方程式为:2Fe2++ H2O2+2H+= 2Fe3++ 2H2O;
(3)加入碳酸钠溶液调pH至4.0~5.0,其目的是促进Fe3+水解转化为氢氧化铁沉淀完全;
(4)草酸镍(NiC2O42H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应(Ni由+2价升高到+3价,则C由+3价降低到+2价,题中要求生成混合气体,则另一气体为CO2),再利用化合价升降相等,Ni:升高2×(3-2),C:升高1×(4-3),C:降低:3×(3-2),生成Ni2O3、CO、CO2,配平方程式为:2NiC2O4![]() Ni2O3+3CO↑+CO2↑,该混合气体的主要成分为水蒸气和CO、CO2 ;
Ni2O3+3CO↑+CO2↑,该混合气体的主要成分为水蒸气和CO、CO2 ;
(5)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确,得到离子方程式为:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O;
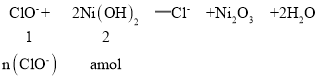
则n(ClO-)=0.5 a mol;
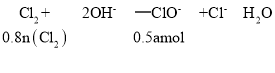
则n(Cl2)=0.625a mol;
进行电解时:
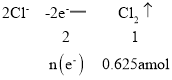
则n(e-)=1.25a mol;
(6)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,发生还原反应,则Al发生氧化反应,碱性条件下得到NaAlO2,该电池反应的化学方程式是:Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2,则放电时负极的电极反应式为Al+4OH--3e-=AlO2-+2H2O。


科目:高中化学 来源: 题型:
【题目】芳香脂I(![]() )是一种重要的香料,工业上合成它的一种路线如下图所示。其中A的结构简式为
)是一种重要的香料,工业上合成它的一种路线如下图所示。其中A的结构简式为![]() ,C是能使溴的CCl4溶液褪色的烃,F是分子中含有一个氧原子的烃的衍生物。
,C是能使溴的CCl4溶液褪色的烃,F是分子中含有一个氧原子的烃的衍生物。

已知:①![]() ;
;
②酯环化合物:分子中含有3个及以上碳原子连接成的碳环,环内两个相邻碳原子之间可以是单键、双键或三键,环的数目可以是一个或多个。
(1)F的相对分子质量大于X,则F的名称为___________,X的结构简式为____________,C→D的另一种产物是HCl,则该反应的反应类型为_________________。
(2)从官能团角度上看,A属于_______物质,能将A、B区别开的试剂是_______,I中的官能团名称为________________________。
(3)写出D→E的化学方程式:_______________________________________________。
(4)B还有多种同分异构体,满足下列条件的同分异构体共有________种(不考虑立体异
构),其中核磁共振氢谱有4组峰,且峰面积之比为1:1: 2: 6的物质的结构简式为_______(任写一种)。
①能发生酯化反应 ②属于脂环化合物
(5)已知:CH3CH2OH+HNO3![]() CH3CH2ON2O(硝酸乙酯)+H2O。请写出以CH2ClCH=CH2为基本原料合成三硝酸甘油酯的合成路线图(无机试剂任选):______________________。
CH3CH2ON2O(硝酸乙酯)+H2O。请写出以CH2ClCH=CH2为基本原料合成三硝酸甘油酯的合成路线图(无机试剂任选):______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间不可能实现如图所示转化的是( )
![]()
选项 | X | Y | Z | M |
A | S | SO2 | SO3 | O2 |
B | HNO3 | Fe(NO3)3 | Fe(NO3)2 | Fe |
C | NaOH | Na2CO3 | Na2CO3 | CO2 |
D | HN3 | NO | NO2 | O2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导材料的一个晶胞(碳原子用小●球,镍原子用大○球, 镁原子用大●球)如图所示。该晶体的化学式是
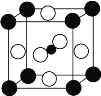
A. Mg2CNi3B. MgC2NiC. MgCNi2D. MgCNi3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体氧化物电解池(SOEC)可实现乙烷电化学脱氢制乙烯,原理示意图如下所示。下列说法错误的是
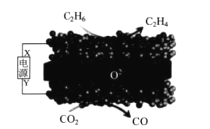
A.X 是电源的正极
B.该装置在工作过程中,O2-在固体氧化物中由下方向上方迁移
C.阴极区发生的反应为:CO2+2e-+2H+=CO+H2O
D.该过程的总反应方程式为:C2H6+CO2=C2H4+CO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图三条曲线表示 C、Si 和 P 元素的前四级电离能变化趋势。下列说法正确的是

A. 元素电负性:c>b>aB. 最简单氢化物的稳定性:c>a>b
C. 最简单氢化物的相对分子质量:a>b>cD. 第五电离能 I5:a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为____________。
(2)X与M组成的物质为_____________(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为__________。
(3)Y在周期表中的位置是____________,其含氧酸的化学式为______________。
(4)L与M形成的化合物中L的化合价是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生产等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量。
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4。
已知:a.CaO(s)+CO2(g)=CaCO3(s) ΔH= -178.3 kJ·mol-1;
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH= -2762.2 kJ·mol-1 ;
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH= -2314.8 kJ·mol-1 。
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:______。
②方法2:用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4。实验测得NH4HSO3溶液中![]() =1500,则溶液的pH为_______。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=1500,则溶液的pH为_______。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
(2)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,反应为COS(g)+H2(g)H2S(g)+CO(g) ΔH>0。
①恒温、恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2mol H-S键的同时形成1 mol H-H键
②T1℃时,在恒容的密闭容器中,将定量的CO和H2S混合加热并达到平衡:H2S(g)+CO(g)COS(g)+H2(g) K=0.25。则该温度下反应COS(g)+H2(g) H2S(g)+CO(g)的平衡常数K'=__。
③T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1mol H2(g),达到平衡时COS的转化率为____。(计算结果保留到小数点后一位)
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为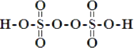 。在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1 mol S2O82-能氧化的Mn2+的物质的量为__mol。
。在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1 mol S2O82-能氧化的Mn2+的物质的量为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图展示了实验室制取少量乙酸乙酯的实验装置。下列关于该反应实验操作及现象的叙述,不正确的是( )
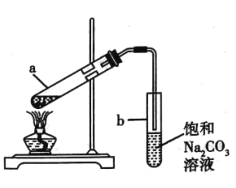
A.向a 试管中先加入乙醇,然后缓缓加入浓硫酸,边加边振荡试管,最后加入乙酸。
B.试管a 中通常加入过量的乙酸,目的在于提高乙醇的转化率
C.试管b 中导气管下端管口不能浸入液面以下,目的在于防止倒吸
D.反应结束后,若观察到试管b 中有少量白色固体析出,该固体可能为NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com